Tìm kiếm phương trình hóa học
Hãy nhập vào chất tham gia hoặc/và chất sản phẩm để bắt đầu tìm kiếm
2H2S + O2 → 2H2O + 2S | Cân Bằng Phương Trình Hóa Học
H2S | hidro sulfua | khí + O2 | oxi | Chất khí = H2O | nước | Lỏng + S | sulfua | chất rắn, Điều kiện Điều kiện khác nhiệt độ cao; O2 thiếu; hidro sunfua bão hòa , Cho hidro sunfua bão hòa tác dụng với oxi thiếu, xuất hiện kết tủa vàng
Giới thiệu
Thông tin chi tiết về phương trình
Điều kiện phản ứng khi cho tác dụng H2S + O2
- Chất xúc tác: không có
- Nhiệt độ: thường
- Áp suất: thường
- Điều kiện khác: không có
Quá trình phản ứng H2S + O2
Quá trình: Cho hidro sunfua bão hòa tác dụng với oxi thiếu
Lưu ý: không có
Hiện tượng xảy ra sau phản ứng H2S + O2
Hiện tượng: xuất hiện kết tủa vàng
Thông tin chi tiết các chất tham gia phản ứng
Thông tin về H2S (hidro sulfua)
- Nguyên tử khối: 34.0809
- Màu sắc: không màu
- Trạng thái: khí
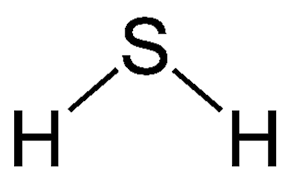
Hydro sunfua được sử dụng chủ yếu để sản xuất axit sunfuric và lưu huỳnh. Nó cũng được sử dụng để tạo ra nhiều loại sulfua vô cơ được sử dụng để tạo ra thuốc trừ sâu, da, thuốc nhuộm và dược phẩm. Hydrogen sulfide được sử dụng để sản xuất nước nặng cho các nhà máy điện hạt nhân (cụ thể là các lò phả...
Thông tin về O2 (oxi)
- Nguyên tử khối: 31.99880 ± 0.00060
- Màu sắc: không màu
- Trạng thái: Chất khí

Oxy là một chất khí không màu, không mùi và không vị là một chất khí cần thiết cho sự tồn tại của con người. Oxy có nhiều ứng dụng trong ngành sản xuất thép và các quá trình luyện, chế tạo kim loại khác, trong hóa chất, dược phẩm, chế biến dầu khí, sản xuất thủy tinh và gốm cũng như sản xuất giấy và...
Thông tin chi tiết các chất sản phẩm sau phản ứng
Thông tin về H2O (nước)
- Nguyên tử khối: 18.01528 ± 0.00044
- Màu sắc: Không màu
- Trạng thái: Lỏng
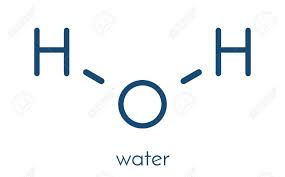
Nước là một hợp chất liên quan trực tiếp và rộng rãi đến sự sống trên Trái Đất, là cơ sở của sự sống đối với mọi sinh vật. Đối với thế giới vô sinh, nước là một thành phần tham gia rộng rãi vào các phản ứng hóa học, nước là dung môi và là môi trường tích trữ các điều kiện để thúc đẩy hay kìm hãm các...
Thông tin về S (sulfua)
- Nguyên tử khối: 32.0650
- Màu sắc: vàng chanh
- Trạng thái: chất rắn
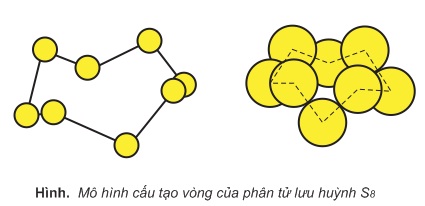
Lưu huỳnh có nhiều ứng dụng công nghiệp. Thông qua dẫn xuất chính của nó là axít sulfuric (H2SO4), lưu huỳnh được đánh giá là một trong các nguyên tố quan trọng nhất được sử dụng như là nguyên liệu công nghiệp. Nó là quan trọng bậc nhất đối với mọi lĩnh vực của nền kinh tế thế giới. Sản xuất axít...
Tổng số đánh giá:
Xếp hạng: / 5 sao
Các phương trình điều chế H2S
Chất xúc tác
thường
Nhiệt độ
thường
Áp suất
thường
Điều kiện khác
thường
Chất xúc tác
thường
Nhiệt độ
thường
Áp suất
thường
Điều kiện khác
thường
Chất xúc tác
thường
Nhiệt độ
temperature
Áp suất
thường
Điều kiện khác
thường
Các phương trình điều chế O2
Chất xúc tác
thường
Nhiệt độ
thường
Áp suất
thường
Điều kiện khác
thường
Chất xúc tác
thường
Nhiệt độ
160 - 300
Áp suất
thường
Điều kiện khác
thường
Chất xúc tác
thường
Nhiệt độ
temperature
Áp suất
thường
Điều kiện khác
thường
Một số định nghĩa cơ bản trong hoá học.
Mol là gì?
Trong hóa học, khái niệm mol được dùng để đo lượng chất có chứa 6,022.10²³ số hạt đơn vị nguyên tử hoặc phân tử chất đó. Số 6,02214129×10²³ - được gọi là hằng số Avogadro.
Xem thêmĐộ âm điện là gì?
Độ âm điện là đại lượng đặc trưng định lượng cho khả năng của một nguyên tử trong phân tử hút electron (liên kết) về phía mình.
Xem thêmKim loại là gì?
Kim loại (tiếng Hy Lạp là metallon) là nguyên tố có thể tạo ra các ion dương (cation) và có các liên kết kim loại, và đôi khi người ta cho rằng nó tương tự như là cation trong đám mây các điện tử.
Xem thêmNguyên tử là gì?
Nguyên tử là hạt nhỏ nhất của nguyên tố hóa học không thể chia nhỏ hơn được nữa về mặt hóa học.
Xem thêmPhi kim là gì?
Phi kim là những nguyên tố hóa học dễ nhận electron; ngoại trừ hiđrô, phi kim nằm bên phải bảng tuần hoàn.
Xem thêmNhững sự thật thú vị về hoá học có thể bạn chưa biết
Sự thật thú vị về Hidro
Hydro là nguyên tố đầu tiên trong bảng tuần hoàn. Nó là nguyên tử đơn giản nhất có thể bao gồm một proton trong hạt nhân được quay quanh bởi một electron duy nhất. Hydro là nguyên tố nhẹ nhất trong số các nguyên tố và là nguyên tố phong phú nhất trong vũ trụ.
Xem thêmSự thật thú vị về heli
Heli là một mặt hàng công nghiệp có nhiều công dụng quan trọng hơn bong bóng tiệc tùng và khiến giọng nói của bạn trở nên vui nhộn. Việc sử dụng nó là rất cần thiết trong y học, khí đốt cho máy bay, tên lửa điều áp và các tàu vũ trụ khác, nghiên cứu đông lạnh, laser, túi khí xe cộ, và làm chất làm mát cho lò phản ứng hạt nhân và nam châm siêu dẫn trong máy quét MRI. Các đặc tính của heli khiến nó trở nên không thể thiếu và trong nhiều trường hợp không có chất nào thay thế được heli.
Xem thêmSự thật thú vị về Lithium
Lithium là kim loại kiềm rất hoạt động về mặt hóa học, là kim loại mềm nhất. Lithium là một trong ba nguyên tố được tạo ra trong BigBang! Dưới đây là 20 sự thật thú vị về nguyên tố Lithium - một kim loại tuyệt vời!
Xem thêmSự thật thú vị về Berili
Berili (Be) có số nguyên tử là 4 và 4 proton trong hạt nhân của nó, nhưng nó cực kỳ hiếm cả trên Trái đất và trong vũ trụ. Kim loại kiềm thổ này chỉ xảy ra tự nhiên với các nguyên tố khác trong các hợp chất.
Xem thêmSự thật thú vị về Boron
Boron là nguyên tố thứ năm của bảng tuần hoàn, là một nguyên tố bán kim loại màu đen. Các hợp chất của nó đã được sử dụng hàng nghìn năm, nhưng bản thân nguyên tố này vẫn chưa bị cô lập cho đến đầu thế kỉ XIX.
Xem thêmSo sánh các chất hoá học phổ biến.
CH2Br và CH2MgBr
Điểm khác nhau về tính chất vật lý, hoá học giữa chất metylbromide và chất methylmagiesiumbromide
Xem thêmCH3CH(Br)CH2(Br) và CH2Br – CHBr – COOH
Điểm khác nhau về tính chất vật lý, hoá học giữa chất 1,2-dibromopropane và chất Axit 2, 3 - dibrompropionic
Xem thêmC5H10Br2 và H-COONa
Điểm khác nhau về tính chất vật lý, hoá học giữa chất 3,3-dibromopentane và chất Natri format
Xem thêmCH2NH2CH2COOH và CH2NH2CH2COONa
Điểm khác nhau về tính chất vật lý, hoá học giữa chất 6-alanine và chất
Xem thêm


