I- STIREN
1. Tính chất vật lí và cấu tạo
Stiren là một chất lỏng không màu, nhẹ hơn nước và không tan trong nước.
Từ kết quả phân tích nguyên tố và xác định khối lượng mol phân tử, người ta đã thiết lập công thức phân tử của stiren là C8H8.
Khi đun nóng stiren với dung dịch kali pemanagat rồi axit hóa thì thu được axit benzoic (C6H5COOH). Điều đó cho thấy stiren có vòng benzen với 1 nhóm thế : C6H5−R với R là C2H3.
Sitren làm mất màu dung dịch nước brom và tạo thành hợp chất có công thức C8H8Br2.
Điều đó chứng tỏ nhóm C2H3 có chứa liên kết đôi, đó là nhóm vinyl: CH2=CH−
Vậy công thức cấu tạo của stiren là
![]() stiren (vinylbenzen, phenyletilen), tnc:−31oC;ts:145oC
stiren (vinylbenzen, phenyletilen), tnc:−31oC;ts:145oC
2. Tính chất hóa học
a) Phản ứng cộng
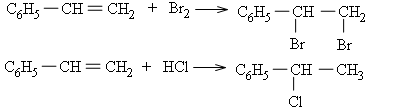
Halogen (Cl2,Br2), hiđro halogenua (HCl,HBr) cộng vào nhóm vinyl ở stiren tương tự như cộng vào anken.
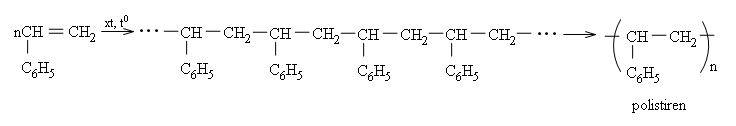
b) Phản ứng trùng hợp và đồng trùng hợp
Phản ứng đồng thời 2 hay nhiều loại monome gọi là phản ứng đồng trùng hợp.
Thí dụ:
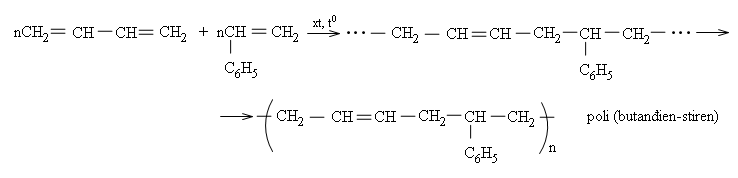
c) Phản ứng oxi hóa
Giống như etilen, stiren làm mất màu dung dịch KMnO4 và bị oxi hóa ở nhóm vinyl, còn vòng benzen vẫn giữ nguyên.
3.Ứng dụng
Ứng dụng quan trọng nhất của stiren là để sản xuất polime, polistiren là một chất nhiệt dẻo, tỏng suốt, dùng chế tạo các dụng cụ văn phòng, đồ dùng gia đình (thước kẻ, vỏ bút bi, eke, cốc, hộp mứt kẹo,...)
Poli (butađien - stiren), sản phẩm đồng trùng hợp stiren với butađien, dùng để sản xuất cao su buna-S, có độ bền cơ học cao hơn cao su buna.
II - NAPHTALEN
1. Tính chất vật lí và cấu tạo
Naphtalen là chất rắn màu trắng, tnc;80oC,ts:218oC, thăng hoa ngay ở nhiệt độ thường, có mùi đặc trưng (mùi băng phiến), khối lượng riêng 1,025g/cm3(25oC);
Không tan trong nước, tan trong dung môi hữu cơ. Công thức phân tử C10H8, cấu tạo bởi hai nhan benzen có chung một cạnh.
2. Tính chất hóa học
Naphtalen có thể được coi như gồm hai vòng benzen giáp nhau nên có tính thơm tương tự như benzen.
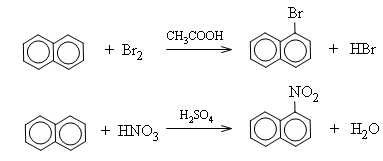
a) Phản ứng thế
Naphtalen tham gia các phản ứng thế dễ hơn so với benzen. Sản phẩm thế vào vị trí số 1 (vị trí α) là sản phẩm chính.
b) Phản ứng cộng hiđro (hiđro hóa)
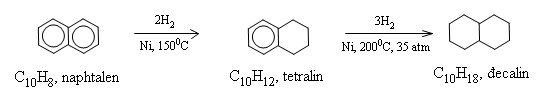
c) Phản ứng oxi hóa
Naphtalen không bị oxi hóa bởi dung dịch KMnO4. Khi có xúc tác V2O5 ở nhiệt độ cao nó bị oxi hóa bởi oxi không khí tạo thành anhiđrit phtalic.
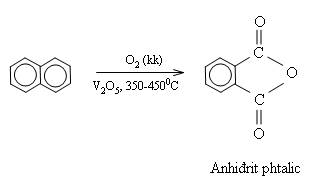
3. Ứng dụng
Naphtalen dùng để sản xuất anhiđrit phtalic, naphtol, naphtylamin,... dùng trong công nghiệp chất dẻo, dược phẩm, phẩm nhuộm. Tatralin và đecalin được dùng làm dung môi. Naphtalen còn dùng làm chất chống gián (băng phiến).