I. CÔNG THỨC CẤU TẠO
1. Khái niệm
Công thức cấu tạo biểu diễn thứ tự và cách thức liên kết ( liên kết đơn, liên kết bội) của các nguyên tử trong phân tử.
2. Các loại công thức cấu tạo
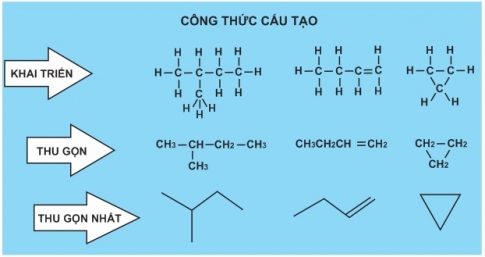
II. THUYẾT CẤU TẠO HÓA HỌC
1. Nội dung
a) Trong phân tử hợp chất hữu cơ, các nguyên tử liên kết với nhau theo đúng hóa trị và theo một thứ tự nhất định. Thứ tự liên kết đó gọi là cấu tạo hóa học. Sự thay đổi thứ tự liên kết đó, tức là thay đổi cấu tạo hóa học, sẽ ra hợp chất khác.
b) Trong phân tử hợp chất hữu cơ, cacbon có hóa trị bốn. Nguyên tử các bon không những có thể liên kết với nguyên tử của nguyên tố khác mà còn liên kết với nhau tạo thành mạch cacbon ( mạch vòng, mạch không vòng, mạch nhánh, mạch không nhánh).
c) Tính chất của các chất phụ thuộc vào thành phần phân tử ( bản chất, số lượng các nguyên tử) và cấu tạo hóa học ( thứ tự liên kết các nguyên tử).
2. Ý nghĩa
Thuyết cấu tạo hoá học giúp giải thích được hiện tượng đồng đẳng, đồng phân
III. ĐỒNG ĐẲNG, ĐỒNG PHÂN
1. Đồng đẳng
Khái niệm: Những hợp chất có thành phần phân tử hơn kém nhau một hay nhiều nhóm CH2 nhưng có tính chất hoá học tương tự nhau là những chất đồng đẳng, chúng hợp thành dãy đồng đẳng.
Ví dụ: C2H4, C3H6, C4H8,… CnH2n
2. Đồng phân
Khái niệm: Những hợp chất khác nhau nhưng có cùng công thức phân tử là những chất đồng phân.
Phân loại: đồng phân lập thể và đồng phân cấu tạo.
Ví dụ: Ancol etylic (CH3 – CH2 – OH) và đimetyl ete (CH3 – O – CH3)
IV. LIÊN KẾT HÓA HỌC VÀ CẤU TRÚC PHÂN TỬ HỢP CHẤT HỮU CƠ
Liên kết đơn (liên kết δ) do một cặp electron dùng chung tạo nên và được biểu diễn bằng một gạch nối giữa hai nguyên tử. Liên kết δ là liên kết bền
Liên kết đôi do 2 cặp eletron chung giữa hai nguyên tử tạo nên. Liên kết đôi gồm một liên kết δ và một liên kết π.
Liên kết ba do 3 cặp electron chung giữa hai nguyên tử tạo nên. Liên kết ba gồm một liên kết δ và hai liên kết π.