I - VỊ TRÍ CỦA NHÓM NITƠ TRONG BẢNG TUẦN HOÀN
Nhóm nitơ gồm các nguyên tố: nitơ (N), photpho (P), asen (As), antimon (Sb) và bitmut (Bi). Chúng đều thuộc các nguyên tố p.
Bảng 2.1. Một số tính chất của các nguyên tố nhóm nitơ
II - TÍNH CHẤT CHUNG CỦA CÁC NGUYÊN TỐ NHÓM NITƠ
1. Cấu hình electron nguyên tử
Lớp electron ngoài cùng của nguyên tử là ns2np3 (có 5 electron)
Ở trạng thái cơ bản, nguyên tử của các nguyên tố nhóm nitơ có 3 electron độc thân, do đó trong một số hợp chất chúng có hóa trị 3.
Đối với nguyên tử của các nguyên tố P,As,Sb và Bi ở trạng thái kích thích, một electron trong cặp electron của phân lớp ns có thể chuyển sang obitan d trống của phân lớp nd.
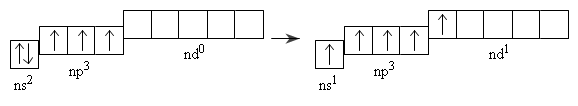
Như vậy, ở trạng thái kích thích nguyên tử của các nguyên tố này có 5 electron độc thân nên có thể có hóa trị năm trong các hợp chất.
2. Sự biến đổi tính chất của các đơn chất
a) Tính oxi hóa - khử
Trong các hợp chất, các nguyên tố nhóm nitơ có số oxi hóa cao nhất là +5. Ngoài ta, chúng còn có các số oxi hóa +3 và −3. Riêng nguyên tử nitơ nên có thêm các số oxi hóa +1,+2,+4.
Do đó khả năng giảm và tăng số oxi hóa trong các phản ứng hóa học, nên nguyên tử các nguyên tố nhóm nitơ thể hiện tính oxi hóa và tính khử. Khả năng oxi hóa giảm dần từ nitơ đến bimut, phù hợp với chiều giảm độ âm điện của nguyên tử các nguyên tố trong nhóm.
b) Tính kim loại - phi kim
Đi từ nitơ đến bimut, tính phi kim của các nguyên tố giảm dần, đồng thời tính kim loại tăng dần. Nitơ , photpho là các phi kim. Asen thể hiện tính phi kim trội hơn tính kim loại. Antimon thể hiện tính kim loại và tính phi kim ở mức độ gần như nhau, còn ở bitmut tính kim loại trội hơn tính phi kim.
3. Sự biến đổi tính chất của các hợp chất
a) Hợp chất với hiđro
Tất cả các nguyên tố nhóm nitơ đều tạo được hợp chất khí với hiđro (hiđrua), có công thức chung là RH3. Độ bền nhiệt của các hiđrua giảm dần từ NH3 đến BiH3. Dung dịch của chúng không có tính axit.
b) Oxit và hiđroxit
Từ nitơ đến bitmut, tính axit của các oxit và hiđroxit tương ứng giảm dần đồng thời tính bazơ của chúng tăng dần. Độ bền của các hợp chất với số oxi hóa tăng, còn độ bền của các hợp chất với số oxi hóa +5 nói chung giảm. Các oxit của nitơ và photpho với số oxi hóa +5(N2O5,P2O5) là oxit axit, hiđroxit của chúng là các axit (HNO3,H3PO4). Trong các oxit với số oxi hóa +3 thì As2O3 là oxit lưỡng tính.