I - CẤU TẠO PHÂN TỬ OXI
Nguyên tử oxi có cấu hình electron 1s22s22p4, lớp ngoài cùng có 2 electron độc thân. Hai nguyên tử O liên kết cộng hóa trị không cực, tạo thành phân tử O2. Công thức cấu tạo của phân tử oxi có thể viết là: O=O
II - TÍNH CHẤT VẬT LÍ VÀ TRẠNG THÁI TỰ NHIÊN CỦA OXI
1. Tính chất vật lí
Oxi là chất khí không màu, không mùi, nặng hơn không khí (d=32/29≈1,1). Dưới áp suất khí quyển, oxi hóa hỏng ở nhiệt độ −183oC.
Khí oxi ít tan trong nước (100ml nước ở 20oC và 1atm hòa tan được 3,1ml khí oxi. Độ tan S=0,0043g/100gH2O).
2. Trạng thái tự nhiên
Oxi trong không khí là sản phẩm của quá trình quang hợp. Cây xanh là nhà máy sản xuất cacbohiđrat và oxi từ cacbon đioxit và nước dưới tác dụng của ánh sáng mặt trời. Nhờ sự quang hợp của cây xanh mà lượng khí oxi trong không khí hầu như không đổi:
6CO2+6H2O −→ (ánhsáng)C6H12O6+6O2
III - TÍNH CHẤT HÓA HỌC CỦA OXI
Nguyên tố oxi có độ âm điện lớn (3,44), chỉ đứng sau flo (3,98). Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Do vậy, oxi là nguyên tố phi kim hoạt động, có tính oxi hóa mạnh. Trong các hợp chất (trừ hợp chất với flo và hợp chất peoxit), nguyên tố oxi có số oxi hóa là −2.
Oxi tác dụng với hầu hết các kim loại (trừ Au,Pt...) và phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
Quá trình oxi hóa các chất đều tỏa nhiệt, phản ứng có thể xảy ra nhanh hay chậm khác nhau phụ thuộc vào các điều kiện: nhiệt độ, bản chất và trạng thái của chất.
Dưới đây là một số thí dụ minh họa cho tính oxi hóa của oxi.
1. Tác dụng với kim loại
Na và Mg cháy sáng chói trong khí oxi, tạo ra hợp chất ion là oxit.
2. Tác dụng với phi kim
Nhiều phi kim cháy khí oxi tạo ra oxit, là những hợp chất liên kết cộng hóa trị có cực
3. Tác dụng với hợp chất
Ở nhiệt độ cao, nhiều hợp chất cháy trong khí oxi tạo ra oxit, là những hợp chất liên kết cộng hóa trị có cực.
IV - ỨNG DỤNG CỦA OXI
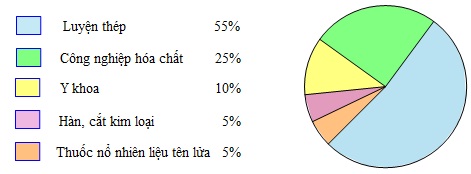
Oxi có vai trò quyết định đối với sự sống của con người và động vật. Mỗi người mỗi ngày cần từ 20−20m3 không khí để thở.
Hàng năm, trên thế giới sản xuất hàng chục triệu tấn oxi để đáp ứng nhu cầu đời sống và sản xuất.
V - ĐIỀU CHẾ OXI
1. Trong phòng thí nghiệm
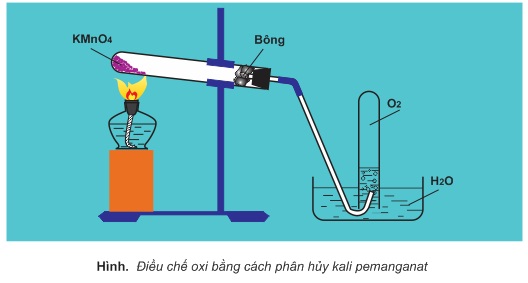
Trong phòng thí nghiệm, người ta điều chế oxi bằng phản ứng phân hủy những hợp chất chứa oxi, kém bền với nhiệt như KMnO4,KClO3,H2O2...
Thí dụ:
Đun nóng KMnO4 hoặc KClO3 với chất xúc tác là MnO2:
2KMnO4 → K2MnO4 + MnO2 + O2↑
2KClO3 → (xúctác:MnO2) 2KCl+3O2↑
Phân hủy hiđro peoxit H2O2 với chất xúc tác là MnO2:
2H2O2→(xúctác:MnO2) 2H2O + O2↑
2. Trong công nghiệp
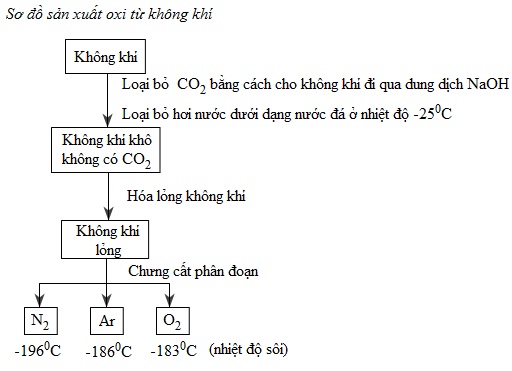
a) Từ không khí
Không khí sau khi đã loại bỏ CO2, bụi và hơi nước, được hóa lỏng. Chưng cất phân đoạn không khí lỏng, thu được khí oxi ở −183oC. Khí oxi được vận chuyển trong những bình thép có dung tích 100lít dưới áp suất 150atm (xem sơ đồ sản xuất oxi từ không khí)
b) Từ nước
Điện phân nước (nước có hòa tan chất điện li, như H2SO4 hoặc NaOH để tăng tính dẫn điện của nước ) người ta thu được khí oxi ở cực dương (anot) và khí hiđro ở cực âm (catot):