I - PHẢN ỨNG OXI HÓA - KHỬ
Chúng ta hãy xét một số phản ứng để hiểu được bản chất của phản ứng oxi hóa - khử.
1. Phản ứng của natri với oxi
Dễ dàng nhận thấy rằng đó là phản ứng oxi hóa - khử vì tồn tại đồng thời sự oxi hóa và sự khử.
Natri kết hợp với oxi, natri là chất khử, còn oxi là chất oxi hóa.
Dựa vào kiến thức về cấu tạo nguyên tử và liên kết ion, ta nhận thấy có sự cho - nhận electron.
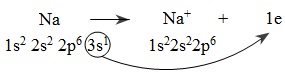
Nguyên tử natri nhường electron:
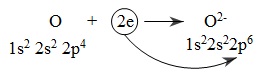
Nguyên tử oxi nhận electron:
Sự hình thành phân tử Na2O:
2Na++O2−→Na2O
Nguyên tử natri nhường electron, là chất khử. Sự nhường electron của natri được gọi là sự oxi hóa nguyên tử natri.
Nguyên tử oxi nhận electron, là chất oxi hóa. Sự nhận electron của oxi được gọi là sự khử nguyên tử oxi.
Ta cũng nhận thấy có sự thay đổi số oxi hóa của nguyên tố tham gia phản ứng:
- Số oxi hóa của nguyên tố natri tăng từ 0 lên +1. Natri là chất khử. Sự làm tăng số oxi hóa của Na là sự oxi hóa nguyên tử natri.
- Số oxi hóa của nguyên tố oxi giảm từ 0 xuống -2. Oxi là chất oxi hóa. Sự làm giảm số oxi hóa của oxi là sự khử nguyên tử oxi.
Vậy có thể nói, trong phản ứng oxi hóa - khử có sự cho - nhận electron hay có sự thay đổi số oxi hóa của một số nguyên tố.
2. Phản ứng của sắt với dung dịch đồng sunfat
Fe+CuSO4→FeSO4+Cu
Ở phản ứng này, ta không thể dựa vào dấu hiệu chất kết hợp với oxi và chất cung cấp oxi để kết luận về phản ứng oxi hóa - khử. Nhưng dựa vào sự cho - nhận electron hoặc sự thay đổi số oxi hóa ta thấy:
Sự cho - nhận electron:
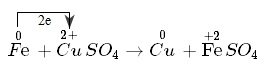
- Nguyên tử sắt nhường electron, là chất khử. Sự nhường electron của nguyên tử sắt được gọi là sự oxi hóa nguyên tử sắt.
- Ion đồng nhận electron, là chất oxi hóa. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
Sự thay đổi số oxi hóa:
- Số oxi hóa của sắt tăng từ 0 đến +2. Nguyên tử sắt là chất khử. Sự làm tăng số oxi hóa của sắt được gọi là sự oxi hóa nguyên tử sắt.
- Số oxi hóa của đồng giảm từ +2 xuống 0. Ion đồng là chất oxi hóa. Sự làm giảm số oxi hóa của ion đồng được gọi là sự khử ion đồng.
Phản ứng của sắt với dung dịch đồng sunfat cũng là phản ứng oxi hóa - khử vì tồn tại đồng thời sự oxi hóa và sự khử.
3. Phản ứng của hiđro với clo
H2+Cl2→2HCl
Ta đã biết liên kết trong phân tử HCl là liên kết cộng hóa trị.Vì vậy, ở phản ứng này không có sự nhường và nhận electron.Tuy nhiên số oxi hóa của các chất trong phản ứng có thay đổi.
Số oxi hóa của hiđro tăng từ 0 lên +1. Hiđro là chất khử. Sự làm tăng số oxi hóa của hiđro là sự oxi hóa nguyên tử hiđro.
Số oxi hóa của clo giảm từ 0 xuống −1. Clo là chất oxi hóa. Sự làm giảm số oxi hóa của clo là sự khử nguyên tử clo.
Trong phản ứng của hiđro với clo xảy ra đồng thời sự oxi hóa và sự khử. Đó cũng là phản ứng oxi hóa - khử.
4. Định nghĩa
Chất khử là chất nhường electron hay là chất có số oxi hóa tăng sau phản ứng. Chất khử còn được gọi là chất bị oxi hóa.
Chất oxi hóa là chất nhận electron hay là chất có số oxi hóa giảm sau phản ứng. Chất oxi hóa còn được gọi là chất bị khử.
Sự oxi hóa (quá trinh oxi hóa) một chất là làm cho chất đó nhường electron hay làm tăng số oxi hóa của chất đó.
Sự khử (quá trình khử) một chất là làm cho chất đí nhận electron hay làm giảm số oxi hóa của chất đó.
Phản ứng oxi hóa - khử là phản ứng hóa học trong đó có sự chuyển electron giữa các chất phản ứng; hay phản ứng oxi hóa - khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
II - LẬP PHƯƠNG TRÌNH HÓA HỌC CỦA PHẢN ỨNG OXI HÓA - KHỬ
Để lập phương trình hóa học của phản ứng oxi hóa - khử, ta cần biết công thức hóa học của các chất tham gia và tạo thành, còn việc lựa chọn hệ số thích hợp đặt trước công thức các chất trong phương trình hóa học có thể thực hiện bằng nhiều phương pháp khác nhau.
Ta sẽ làm quen với một trong các phương pháp: Đó là phương pháp thăng bằng electron. Phương pháp này dựa trên nguyên tắc: Tổng số electron do chất khử nhường phải đúng bằng tổng số electron mà chất oxi hóa nhận.
Để lập phương trình hóa học của phản ứng oxi hóa - khử theo phương pháp thăng bằng electron, ta thực hiện các bước sau đây:
Thí dụ 1: Lập phương trình hóa học của phản ứng oxi hóa - khử sau:
Fe2O3+CO→Fe+CO2
Bước 1: Xác định số oxi hóa của những nguyên tố có số oxi hóa thay đổi.
Bước 2: Viết quá trinh oxi hóa và quá trình khử, cân bằng mỗi quá trình.
Bước 3: Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hóa nhận.
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học:
Fe2O3+3CO→2Fe+3CO2
III - Ý NGHĨA CỦA PHẢN ỨNG OXI HÓA - KHỬ
Phản ứng oxi hóa - khử là một trong những quá trình quan trọng nhất của thiên nhiên. Sự hô hấp, quá trình thực vật hấp thụ khí cacbonic giải phóng oxi, sự trao đổi chất và hàng loạt quá trình sinh học khác đều có cơ sở là các phản ứng oxi hóa - khử.
Sự đốt cháy nhiên liệu trong các động cơ, các quá trình điện phân, các phản ứng xảy ra trong pin và trong ăcquy đều bao gồm sự oxi hóa và sự khử. Hàng loạt quá trình sản xuất như luyện kim, chế tạo hóa chất, chất dẻo, dược phẩm, phân bón hóa học,...đều không thực hiện được nếu thiếu các phản ứng oxi hóa - khử.