I. VỊ TRÍ VÀ CẤU HÌNH ELECTRON NGUYÊN TỬ
- Vị trí nitơ: ô thứ 7, chu kỳ 2, nhóm VA.
- Cấu hình e: 1s22s22p3
- Cấu tạo phân tử nitơ:
- CTPT: N2.
- Công thức electron:
- Công thức cấu tạo: N≡N
⇒ 2 nguyên tử trong phân tử nitơ có 3 liên kết cộng hóa trị không cực.
II. TÍNH CHẤT VẬT LÝ
Ở điều kiện thường:
Là chất khí không màu, không mùi, không vị.
Nhẹ hơn không khí
Hóa lỏng ở -196oC, hóa rắn ở -210oC.
Rất ít tan trong nước.
Không duy trì sự cháy và sự sống.
III. TÍNH CHẤT HÓA HỌC
- Nitơ là phi kim khá hoạt động (độ âm điện = 3), nhưng ở nhiệt độ thường khá trơ về mặt hóa học. Do 2 nguyên tử N liên kết với nhau bằng 1 liên kết ba không phân cực nên rất bền do năng lượng liên kết lớn, nên nitơ khá trơ về mặt hóa học ở nhiệt độ thường.
- Số oxi hóa của nitơ trong hợp chất với hidro, kim loại là -3, trong hợp chất với oxi, flo là từ +1 → +5.
- Tùy thuộc vào sự thay đổi số oxi hóa, nitơ có thể thể hiện tính khử hay tính oxi hóa. (chủ yếu là tính oxi hóa).
1. Tính oxi hóa
* Tác dụng với kim loại:
Ở nhiệt độ cao, Nitơ tác dụng được với một số kim loại hoạt động như Ca, Mg, Al tạo nitrua kim loại:
3Mg + N2 -> (nhiệt độ) Mg3N2
*Tác dụng với hidro: N2 + 3H2 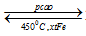 2NH3
2NH3
Ở nhiệt độ cao, áp suất cao và có mặt chất xúc tác, nito tác dụng trực tiếp với hidro, tạo ra khi amoniac
2. Tính khử

Sấm chớp cung cấp năng lượng cho phản ứng giữa Nito và Oxi
Ở nhiệt độ khoảng 3000oC (hoặc hồ quang điện, hoặc tia lửa điện hình thành sấm sét) đã cung cấp năng lượng cho phản ứng nitơ kết hợp trực tiếp với O2 tạo nitơ monoxit NO
N2 + O2 ![]() 2NO
2NO
NO kết hợp dễ dàng với oxi: 2NO + O2 ⇌ 2NO2
IV. ỨNG DỤNG
- Là thành phần cấu tạo nên protêin, thành phần dinh dưỡng chính của thực vật. N2 có nhiệt độ sôi thấp nên dùng làm lạnh trong công nghiệp và trong phòng thí nghiệm.
Công nghiệp:
- Tổng hợp NH3, sản xuất HNO3, phân đạm…
- Môi trường trơ trong luyện kim, thực phẩm, điện tử…
Y tế: N2 lỏng: bảo quản mẫu máu, các mẫu vật sinh học khác…
- Dựa vào tính trơ của nitơ mà bảo quan tranh vẽ trong viện bảo tàng chứa đầy khí nitơ trong ống của cuộn tranh tránh các phân tử khác bị oxi hóa hư màu vẽ.
- Bơm vào bóng đèn điện để giảm sự bốc hơi kim loại trên bề mặt dây tóc.
- Bơm nitơ vào phổi bệnh nhân lao để ép lá phổi cho nó nghỉ ngơi…
V. TRẠNG THÁI TỰ NHIÊN
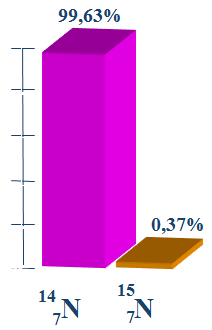
Phần trăm mỗi đồng vị của Nito
Ở dạng hợp chất, nitơ có nhiều trong khoáng chất natri nitrat NaNO3 với tên gọi là diêm tiêu natri
VI. ĐIỀU CHẾ
1. Trong công nghiệp
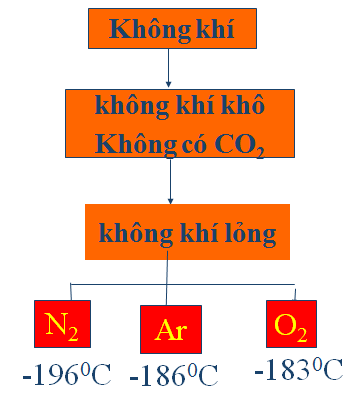
Chưng cất phân đoạn không khí lỏng
2. Trong phòng thí nghiệm
NH4NO2 .png) N2 + 2H2O
N2 + 2H2O
NH4Cl + NaNO2 ![]() NaCl + N2+2H2O
NaCl + N2+2H2O