I. NGUYÊN TẮC NHẬN BIẾT MỘT ION TRONG DUNG DỊCH
Để nhận biết một ion trong dung dịch, người ta thêm vào dung dịch một thuốc thử tạo với ion đó một sản phẩm đặc trưng như một kết tủa, một hợp chất có màu hoặc một chất khí khó tan sủi bọt hoặc một khí bay khỏi dung dịch.
II. NHẬN BIẾT MỘT SỐ CATION TRONG DUNG DỊCH
1. Nhận biết cation Na+
Cho một ít muối natri dưới dạng dung dịch hoặc muối rắn lên một dây platin hình khuyên (dây platin đã được nhúng nhiều lần vào dung dịch HCl sạch) gắn với một đũa thuỷ tinh nhỏ (dùng làm cán) rồi đưa đầu dây hình khuyên đó vào ngọn lửa đèn khí không màu thì kết luận sự có mặt ion Na+ khi ngọn lửa có màu vàng tươi.
2. Nhận biết cation
Khi thêm lượng dư dung dịch kiềm NaOH hoặc KOH vào dung dịch chứa ion amoni rồi đun nóng nhẹ, giải phóng khí NH3 có mùi khai hoặc sự đổi màu của giấy quỳ tím tẩm ướt bằng nước cất sang màu xanh thì kết luận sự có mặt cation.png)
3. Nhận biết cation Ba2+
Dùng dung dịch H2SO4 loãng làm thuốc thử tạo với ion Ba2+ kết tủa màu trắng không tan trong thuốc thử dư.
4. Nhận biết cation Al3+
Cation này tạo ra hiđroxit lưỡng tính. Khi thêm từ từ dung dịch kiềm vào dung dịch Al3+, đầu tiên hiđroxit Al(OH)3 kết tủa sau đó kết tủa này tan trong thuốc thử dư.
5. Nhận biết các cation Fe2+và Fe3+
- Nhận biết cation Fe3+
Thêm dung dịch kiềm (OH-),... hoặc NH3 vào dung dịch Fe3+, tạo thành kết tủa Fe(OH)3 màu nâu đỏ.
- Nhận biết cation Fe2+
Thêm dung dịch kiềm (OH-) hoặc NH3 vào dung dịch Fe2+ thì tạo thành kết tủa Fe(OH)2 có màu trắng hơi xanh chuyển dần sang màu vàng rồi cuối cùng thành màu nâu đỏ (do Fe(OH)2 tiếp xúc với oxi không khí và bị oxi hóa thành Fe(OH)3).
- Nhận biết cation Cu2+
Dùng dung dịch NH3 để thử. Đầu tiên kết hợp với ion Cu2+ tạo kết tủa Cu(OH)2 màu xanh, sau đó kết tủa này bị hòa tan trong thuốc thử dư tạo thành dung dịch có màu xanh lam đậm.
III. NHẬN BIẾT MỘT SỐ ANION TRONG DUNG DỊCH
1. Nhận biết anion
Dùng bột Cu hoặc một vài mẩu lá Cu mỏng trong môi trường axit (axit sunfuric loãng) để nhận biết anion ![]()
Bột Cu tan ra tạo thành dung dịch màu xanh, khí NO không màu bay lên gặp khí oxi của không khí, tạo thành khí NO2 có màu nâu đỏ đặc trưng.
2. Nhận biết anion 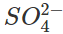
Dùng dung dịch BaCl2 trong môi trường axit loãng dư (dung dịch HCl hoặc HNO3 loãng) vì một loạt anion như ![]() cũng cho kết tủa trắng với ion Ba2+, nhưng chúng đều tan trong các dung dịch HCl hoặc HNO3 loãng, riêng BaSO4 không tan.
cũng cho kết tủa trắng với ion Ba2+, nhưng chúng đều tan trong các dung dịch HCl hoặc HNO3 loãng, riêng BaSO4 không tan.
3 .Nhận biết anion Cl-
Dùng dung dịch AgNO3 trong môi trường HNO3 loãng, phản ứng tạo ra kết tủa trắng.
4. Nhận biết anion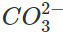
Dùng dung dịch axit (HCl hoặc H2SO4 loãng) axit hóa dung dịch![]() thì CO2 sẽ giải phóng ra khỏi dung dịch, gây sủi bọt khá mạnh. Nếu dẫn khí CO2 vào bình đựng lượng dư nước vôi trong, sẽ quan sát được sự tạo thành kết tủa trắng CaCO3 làm vẩn đục nước vôi trong.
thì CO2 sẽ giải phóng ra khỏi dung dịch, gây sủi bọt khá mạnh. Nếu dẫn khí CO2 vào bình đựng lượng dư nước vôi trong, sẽ quan sát được sự tạo thành kết tủa trắng CaCO3 làm vẩn đục nước vôi trong.
Có thể sử dụng các phản ứng đã nêu để nhận biết hoặc phân biệt các ion trong các dung dịch riêng hoặc dung dịch hỗn hợp đơn giản chứa các ion.