I - TRẠNG THÁI TỰ NHIÊN. ĐIỀU CHẾ
1. Trạng thái tự nhiên
Trong tự nhiên, nguyên tố flo chỉ có ở dạng hợp chất. Hợp chất của flo có trong men răng của người và động vật, trong lá của một số loài cây. Phần lớn flo tập trung trong hai khoáng vật là florit(CaF2) và criolit(Na3AlF6hayAlF3.3NaF).
2. Điều chế
Vì flo có tính oxi hóa mạnh nhất nên phương pháp duy nhất để điều chế flo là dùng dòng điện để oxi hóa ion F− trong florua nóng chảy (phương pháp điện phân). Trong công nghiệp, người ta điện phân hỗn hợp KF+2HF (nhiệt độ nóng chảy 70oC). Bình điện phân có cực âm làm bằng thép đặc biệt hay đồng và cực dương bằng than chì. Khí hiđro thoát ra ở cực âm và khí flo thoát ra ở cực dương.
II - TÍNH CHẤT, ỨNG DỤNG
1. Tính chất
Ở điều kiện thường, flo là chất khí màu lục nhạt, rất độc.
Chúng ta đã biết, nguyên tố flo có độ âm điện lớn nhất. Vì vậy, flo là phi kim mạnh nhất.
Flo oxi hóa được tất cả các kim loại kể cả vàng và platin. Nó cũng tác dụng trực tiếp với hầu hết phi kim, trừ oxi và nitơ.
Phản ứng của flo với hiđro nổ mạnh ngay ở nhiệt độ rất thấp (−252oC) . Đó là phản ứng tỏa nhiệt mạnh:
H2(k)+F2(k)→2HF(k);ΔH=−288,6kJ
Flo cũng tác dụng mạnh với rất nhiều hợp chất vô cơ và hữu cơ. Ngay cả nước, khi đun nóng sẽ bốc cháy trong flo, giải phóng oxi. Như vậy, flo oxi hóa được oxi từ số oxi hóa −2 lên 0:
2F2 + 2H2O → 4HF +O2
2. Ứng dụng
Flo được dùng làm chất oxi hóa cho nhiên liệu lỏng dùng trong tên lửa. Ứng dụng chủ yếu của flo là dưới dạng các dẫn xuất. Từ flo điều chế một số dẫn xuất hiđrocacbon có những tính chất độc đáo, thí dụ teflon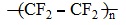 là một chất dẻo chứa flo chịu được tác dụng của axit, kiềm và các hóa chất khác. Freon (chủ yếu là CFCl3 và CF2Cl2) được dùng trong các tủ lạnh và máy lạnh. Khi được thải ra khí quyển, freon phá hủy tầng ozon gây hai cho môi trường. Vì vậy chúng đang được thay thế dần bằng các chất khác.
là một chất dẻo chứa flo chịu được tác dụng của axit, kiềm và các hóa chất khác. Freon (chủ yếu là CFCl3 và CF2Cl2) được dùng trong các tủ lạnh và máy lạnh. Khi được thải ra khí quyển, freon phá hủy tầng ozon gây hai cho môi trường. Vì vậy chúng đang được thay thế dần bằng các chất khác.
Dung dịch NaF loãng được dùng làm thuốc chống sâu răng.
Flo còn được dùng trong công nghiệp sản xuất nhiên liệu hạt nhân để làm giàu 235U.
III - MỘT SỐ HỢP CHẤT CỦA FLO
1. Hiđro florua và axit flohiđric
Vì phản ứng của flo với hiđro quá mãnh liệt nên phương pháp duy nhất để điều chế hiđro florua là cho canxi florua tác dụng với axit sunfuric đặc ở 250oC:
CaF2+H2SO4→CaSO4+2HF
Hiđro florua có nhiệt độ sôi (+19,5oC) cao hơn hẳn nhiệt độ sôi của hiđro clorua (−84,9oC). Hiđro clorua tan vô hạn trong nước tạo ra dung dịch axit flohiđric. Khác với axit clohiđric, axit flohiđric là axit yếu.
Tính chất đặc biệt của axit flohiđric là tác dụng với silic đioxit (có trong thành phần của thủy tinh).
SiO2+4HF→SiF4+2H2O
Silic tetraflorua
Vì vậy, người ta đựng axit flohiđric trong các chai lọ bằng chất dẻo. Axit flohiđric được dùng để khắc chữ nổi lên thủy tinh.
Muối của axit flohiđric là florua.AgF dễ tan trong nước (khác với AgCl,AgBr,AgI). Các muối florua đều độc.
2. Hợp chất của flo với oxi
Vì độ âm điện của flo lớn hơn oxi nên trong hợp chất OF2, flo có số oxi hóa −1 và oxi có số oxi hóa +2.
Oxi florua (OF2) được điều chế bằng cách cho flo qua dung dịch NaOH loãng (khoảng 2%) và lạnh:
2F2+2NaOH→2NaF+H2O+OF2
OF2 là chất khí không màu, có mùi đặc biệt, rất độc. là chất oxi hóa mạnh, OF2 tác dụng với hầu hết các kim loại và phi kim tạo thành oxit và florua.