I- KHÁI NIỆM VỀ CẶP OXI HÓA - KHỬ CỦA KIM LOẠI
Trong phản ứng hóa học, cation kim loại có thể nhận electron để trở thành nguyên tử kim loại và ngược lại, nguyên tử có thể nhường electron để trở thành cation kim loại.
Thí dụ:
.png)
Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa - khử. Các cặp oxi hóa - khử được viết như sau: Fe2+/Fe;Cu2+/Cu;Ag+/Ag
Tổng quát: Mn+/M
II- PIN ĐIỆN HÓA
1. Khái niệm về pin điện hóa, suất điện động và thế điện cực
- Hai cốc thủy tinh, một cốc chứa 50 ml dung dịch CuSO4 1M, cốc kia chứa 50 ml dung dịch ZnSO4 1M. Nhúng một lá Cu vào dung dịch CuSO4, một lá Zn vào dung dịch ZnSO4. Nối hai dung dịch bằng một ống hình chữ U đựng dung dịch NH4NO3 hoặc KNO3. Ống này được gọi là cầu muối. Thiết bị nói trên được gọi là pin điện hóa, vì khi nối hai lá kim loại bằng một dây dẫn sẽ đo được một dòng điện đi từ lá Cu (điện cực +) đến lá Zn (điện cực −).
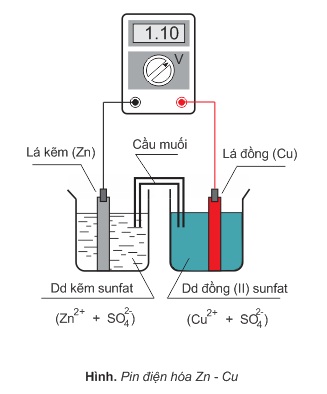
- Sự xuất hiện dòng điện đi từ cực đồng sang cực kẽm chứng tỏ rằng có sự chênh lệch điện cực nói trên, tức là trên mỗi điện cực đã xuất hiện một thế điện cực nhất định.
Hiệu điện thế lớn nhất giữa hai điện cực Epin, tức là hiệu của thế điện cực dương (E+) với thế điện cực âm (E−) được gọi là suất điện động của pin điện hóa (Epin=E+−E−).
Suất điện động của pin điện hóa luôn là số dương và phụ thuộc vào bản chất của kim loại làm điện cực, nồng độ dung dịch và nhiệt độ.
Suất điện động của pin điện hóa khi nồng độ ion kim loại đều bằng 1M (ở 250C) gọi là suất điện động chuẩn và được kí hiệu là E0pin. Tương tự trên ta có: E0pin=E0(+)−E0(−). Đối với pin điện hóa Zn−Cu như hình trên ta có: Eopin=Eo(Cu2+/Cu)−Eo(Zn2+/Zn)
Suất điện động có thể đo được bằng vôn kế có điện trở lớn. Vôn kế cho biết suất điện động của pin điện hóa nói trên: (Epin)=1,10V
2. Cơ chế phát sinh dòng điện trong pin điện hóa
- Ở lá Zn, các nguyên tử kẽm để lại electron trên bề mặt điện cực và tan vào dung dịch dưới dạng ion Zn2+.Ở đây xảy ra sự oxi hóa các nguyên tử Zn2+:
Zn→Zn2++2e
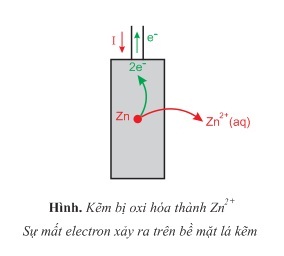
- Lá Zn trở thành nguồn electron nên đóng vai trò cực âm. Các electron theo dây dẫn cực Cu. Ở đây, xảy ra sự khử các ion Cu2+ trong dung dịch thành Cu bám trên bề mặt lá Cu:
Cu2++2e→Cu
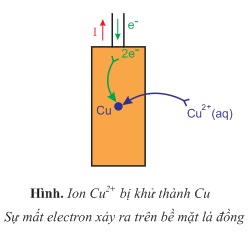
- Trong cầu muối, các cation NH+4 hoặc K+ di chuyển sang cốc đựng dung dịch CuSO4, các anion NO−3 di chuyển sang cốc đựng dung dịch ZnSO4 làm cân bằng điện tích, nên các dung dịch luôn trung hòa điện.
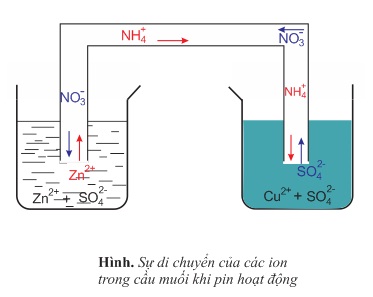
Ở mạch ngoài (dây dẫn ), dòng electron đi từ cực kẽm sang cực đồng, nghĩa là theo quy ước của điện học, dòng điện đi từ cực đồng sang cực kẽm. Vì thế, cực điện kẽm được gọi là anot. Theo cơ chế trên, anot là nơi xảy ra sự oxi hóa. Điện cực đồng gọi là catot. Về bản chất điện hóa học thì catot là nơi xảy ra sự khử ion Cu2+.
Trong pin điện hóa, anot là cực âm, còn catot là cực dương.
- Các phản ứng oxi hóa hóa và khử xảy ra trên bề mặt các điện cực của pin điện hóa nói trên có thể được viết tổng hợp lại bằng phương trình ion rút gọn: Zn+Cu2+→Cu+Zn2+
Như vậy, trong pin điện hóa Zn−Cu đã xảy ra phản ứng oxi hóa- khử: Cu2+ (chất oxi hóa mạnh hơn) đã oxi hóa Zn (chất khử mạnh hơn) thành Zn2+ (chất oxi hóa yếu hơn) và Cu (chất khử yếu hơn) và năng lượng hóa học của phản ứng oxi hóa - khử đã chuyển hóa thành điện năng.
III- THẾ ĐIỆN CỰC CHUẨN CỦA KIM LOẠI
Như đã nói ở trên, suất điện động chuẩn, tức là hiệu các thế điện cực của các điện cực chuẩn đo được bằng vôn kế. Nhưng không thể đo được giá trị tuyệt đối thế điện cực của các điện cực chuẩn. Để giải quyết khó khăn này, người ta đưa ra một điện cực so sánh và chấp nhận một cách quy ước rằng thế điện cực của nó bằng không. Đó là điện cực hiđro chuẩn.
1. Điện cực hiđro chuẩn.
- Cấu tạo của điện cực hiđro chuẩn gồm một tấm platin được phủ muội platin, nhúng trong dung dịch axit có nồng độ ion H+ là 1M. Bề mặt điện cực hấp phụ khí hiđro, được thổi liên tục vào dung dịch dưới áp suất 1 atm. Như vậy, trên bề mặt điện cực hiđro xảy ra cân bằng oxi hóa - khử của cặp oxi hóa - khử 2H+/H2:
H2⇌2H++2e
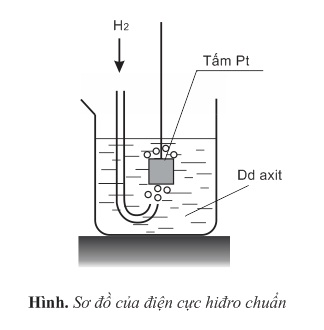
- Người ta chấp nhận một cách quy ước rằng thế điện cực của điện cực hiđro chuẩn bằng 0,00V ở mọi nhiệt độ, tức là: Eo2H+/H2=0,00V
2. Thế điện cực chuẩn của kim loại
Điện cực kim loại mà nồng độ ion kim loại trong dung dịch bằng 1M được gọi là là điện cực chuẩn
Để xác định thế điện cực chuẩn của kim loại nào đó, ta thiết lập một pin điện hóa gồm: điện cực chuẩn của kim loại cần xác định với điện cực hiđro chuẩn, (thí dụ như hình dưới). Vì thế điện cực của điện cực hiđro chuẩn được quy ước bằng không, nên thế điện cực chuẩn của kim loại cần đo được chấp nhận bằng suất điện động của pin tạo bởi điện cực chuẩn của kim loại cần đo.
Trong pin điện hóa nói trên, nếu kim loại đóng vai trò cực âm, thì thế điện cực chuẩn của kim loại có giá trị âm. Còn nếu kim loại đóng vai trò cực dương, thì thế điện cực chuẩn của kim loại có giá trị dương.
Trong các bẳng số liệu thường người ta cho giá trị thế điện cực chuẩn ở 25oC.
Thí dụ 1: Xác định thế điện cực chuẩn của cặp Zn2+/Zn
Cho pin điện hóa Zn−H2 như hình dưới. Điện kế cho biết dòng điện đi từ điện cực hiđro chuẩn sang điện cực kẽm chuẩn và suất điện động của pin bằng 0,76V (kí hiệu là EoZn2+/Zn=−0,76V).
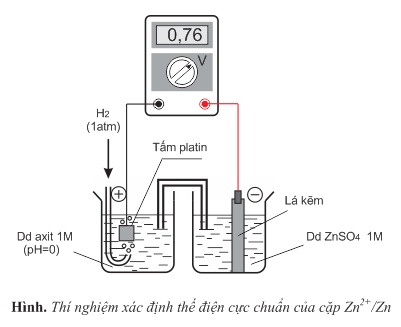
Phản ứng xảy ra trên điện cực âm (anot): Zn→Zn2++2e
Phản ứng xảy ra trên điện cực dương (catot): 2H++2e→H2
Phản ứng oxi hóa - khử xảy ra trong pin điện hóa: Zn+2H+→Zn2++H2
Thí dụ 2: Xác định thế điện cực chuẩn của cặp Ag+/Ag
Cho pin điện hóa H2−Ag như hình dưới. Điện kế cho biết dòng điện ở mạch ngoài đi từ điện cực bạc chuẩn sang điện cực hiđro chuẩn và suất điện động của pin bằng 0,80V. Như vậy, thế điện cực chuẩn của cặp Ag+/Ag là +0,80 (kí hiệu là EoAg+/Ag=+0,80V).
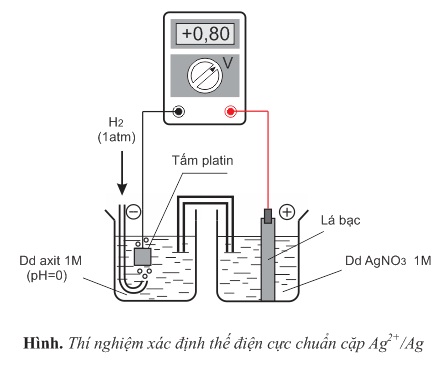
Phản ứng xảy ra trên điện cực âm (anot): H2→2H++2e
Phản ứng xảy ra trên điện cực dương (catot): Ag++e→Ag
Phản ứng oxi hóa - khử xảy ra trong pin điện hóa: 2Ag++H2→2Ag+2H+
IV- DÃY THẾ ĐIỆN CỰC CHUẨN CỦA KIM LOẠI
Dãy thế điện cực chuẩn của kim loại là dãy sắp xếp các kim loại theo thứ tự tăng dần thế điện cực chuẩn.
Dưới đây là dãy thế điện cực chuẩn ở 25oC của một số cặp oxi hóa - khử Mn+/M (M là những kim loại thông dụng) có trị số tính ra vôn (V):
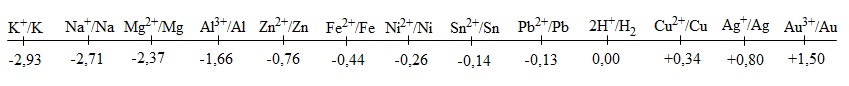
V- Ý NGHĨA CỦA DÃY THẾ ĐIỆN CỰC CHUẨN CỦA KIM LOẠI
1. So sánh tính oxi hóa - khử
Trong dung môi nước, thế điện cực chuẩn của kim loại E0Mn+/M càng lớn thì tính oxi hóa của cation Mn+ càng mạnh và tính khử của kim loại M càng yếu. Ngược lại, E0Mn+/M càng nhỏ thì tính oxi hóa của cation Mn+ càng yếu và tính khử của kim loại M càng mạnh.
2. Xác định chiều của phản ứng oxi hóa - khử
a) Kim loại của cặp oxi hóa - khử có thế điện cực chuẩn nhỏ hơn khử được cation kim loại của cặp oxi hóa - khử có thế điện cực chuẩn lớn hơn (nói cách khác, cation kim loại trong cặp oxi hóa - khử có thế điện cực chuẩn lớn hơn có thể oxi hóa được kim loại trong cặp có thế điện cực chuẩn nhỏ hơn).
Để viết đúng chiều của phản ứng oxi hóa - khử, người ta viết cặp oxi hóa - khử có thế điện cực chuẩn nhỏ ở bên trái, cặp oxi hóa - khử có thế điện cực chuẩn lớn hơn ở bên phải rồi viết phương trình phản ứng oxi hóa - khử theo quy tắc α
Thí dụ: E0Cu2+Cu=+0,34V và E0Ag+/Ag=+0,80V, ta có:
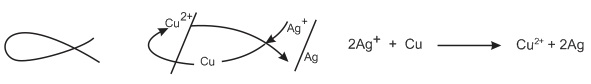
Chữ anpha quy tắc α
b) Kim loại trong cặp oxi hóa - khử có thế điện cực chuẩn âm khử được ion hiđro của dung dịch axit (nói cách khác, cation H+ trong cặp 2H+/H2 có thể oxi hóa được kim loại trong cặp oxi hóa - khử có thế điện cực chuẩn âm).
Thí dụ: E0Mg2+/Mg=−2,37V và E02H+/H2=0,00V, ta có:
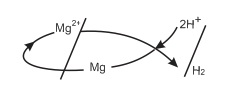
Phản ứng oxi hóa - khử xảy ra theo chiều cation H+ trong dung dịch axit oxi hóa Mg thành cation Mg2+ và cation H+ bị khử thành H2:
Mg+2H+→Mg2++H2
3. Xác định suất điện động chuẩn của pin điện hóa
Suất điện động chuẩn của pin điện hóa (E0pin) bằng thế điện cực chuẩn của cực dương trừ đi thế điện cực chuẩn của cực âm. Suất điện động của pin điện hóa luôn là số dương.
Thí dụ:
Suất điện động chuẩn của pin điện hóa Zn−Cu:
E0pin=E0Cu2+/Cu−E0Zn2+/Zn
=0,34V−(−0,76V)
=1,10V
Suất điện động chuẩn của pin điện hóa Zn−Pb:
E0pin=E0Pb2+/Pb−E0Zn2+/Zn
=−0,13V−(−0,76V)
=0,63V
4. Xác định thế điện cực chuẩn của cặp oxi hóa - khử
Ta có thể xác định được thế điện cực chuẩn của cặp oxi hóa - khử khi biết suất điện động chuẩn của pin điện hóa (E0pin) và thế điện cực chuẩn của cặp oxi hóa - khử còn lại.
Thí dụ:
.png)