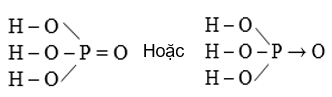A. AXIT PHOTPHORIC
I. CẤU TẠO PHÂN TỬ
Photpho có số oxi hóa là +5
II. TÍNH CHẤT VẬT LÝ
- Tinh thể trong suốt, nóng chảy ở 42,5oC. Rất háo nước nên dễ chảy rữa, tan trong nước ở bất kì tỉ lệ nào.
- Dung dịch axit photphoric là dung dịch đặc, sánh, không màu, có nồng độ 85%.
III. TÍNH CHẤT HÓA HỌC
1. Trong nước H3PO4 phân li theo 3 nấc:
H3PO4 ⇆ H+ + H2PO4-
H2PO4- ⇆ H+ + HPO42-
HPO4 2- ⇆ H+ + PO43-
2. Tác dụng với dung dịch kiềm
Tuỳ theo tỉ lệ chất tham gia phản ứng mà H3PO4 sinh ra muối axít hoặc muối trung hoà, hoặc hỗn hộp các muối đó
H3PO4 + NaOH → NaH2PO4 + H2O
H3PO4 + 2NaOH → Na2HPO4+ 2H2O
H3PO4 + 3NaOH → Na3PO4 + 3H2O
3. H3PO4 không có tính oxi hóa
IV. ĐIỀU CHẾ
1. Trong phòng thí nghiệm
Axit photphoric được điều chế bằng cách dùng axit nitric đặc oxi hóa photpho:
P + 5HNO3 ->(nhiệt độ) H3PO4 + 5NO2 + H2O
2. Trong công nghiệp
Từ quặng photphorit hoặc apatit:
Ca3(PO4)2 + 3H2SO4 (đ) → 2H3PO4 + 3CaSO4
→ H3PO4 thu được không tinh khiết.
- Từ photpho
4P + 5O2 → 2P2O5
P2O5 + 3H2O → 2H3PO4
→ Phương pháp này H3PO4 có độ tinh khiết và nồng độ cao hơn.
V. ỨNG DỤNG
- Điều chế muối photphat
- Sản xuất phân lân, thuốc trừ sâu
- Dược phẩm
B. MUỐI PHOTPHAT
I. TÍNH TAN
- Muối trung hoà và muối axit của kim loại Na, K đều tan trong nước
- Với các kim loại khác: Chỉ muối đihiđrophotphat tan, còn lại đều không tan hoặc ít tan
II. NHẬN BIẾT ION PHOTPHAT
- Thuốc thử: Dung dịch AgNO3
- Hiện tượng: Kết tủa màu vàng
- Phương trình hóa học: 3Ag+ + PO4 3- → Ag3PO4 (màu vàng)