I - CẤU TẠO PHÂN TỬ
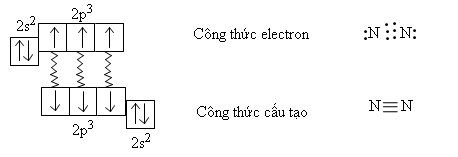
Nguyên tử nitơ có cấu hình electron 1s22s22p3, phân lớp ngoài cùng có 3 electron độc thân. Hai nguyên tử nitơ liên kết với nhau bằng ba liên kết cộng hóa trị không có cực, tạo thành phân tử N2.

II - TÍNH CHẤT VẬT LÍ
Ở điều kiện thường, nitơ là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, hóa lỏng ở −196oC, hóa rắn ở −210oC. Khí nitơ tan rất ít trong nước (ở điều kiện thường, 1 lít nước hòa tan được 0,015 lít khí nitơ ). Nitơ không duy trì sự cháy và hô hấp.
III - TÍNH CHẤT HÓA HỌC
Vì có liên kết ba với năng lượng liên kết lớn (EN≡N=946kJ/mol) nên phân tử nitơ rất bền. Ở nhiệt độ thường, nitơ khá trơ về mặt hóa học nhưng ở nhiệt độ cao nitơ trở nên hoạt động hơn và có thể tác dụng với nhiều chất.
Nguyên tử nitơ có độ âm điện lớn chỉ nhỏ hơn độ âm điện của flo, clo và oxi. Tùy thuộc vào chất phản ứng mà nitơ thể hiện tính oxi hóa hay tính khử. Tuy nhiên, tính oxi hóa vẫn trội hơn tính khử.
1. Tính oxi hóa
a) Tác dụng với hiđro
Ở nhiệt độ cao (trên 400oC), áp suất cao và có chất xúc tác, nitơ tác dụng trực tiếp với hiđro tạo ra khí amoniac. Đây là phản ứng thuận nghịch và tỏa nhiệt.

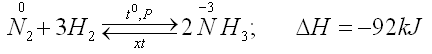
b) Tác dụng với kim loại
* Ở nhiệt độ thường, nitơ chỉ tác dụng với kim loại liti, tạo thành liti nitrua:
6Li+N2→2Li3N
* Ở nhiệt độ cao, nitơ tác dụng với một số kim loại như Ca,Mg,Al,...
3Mg+N2→to Mg3N2 (magienitrua)
Trong các phản ứng với hiđro và kim loại, số oxi hóa của nitơ giảm: nitơ thể hiện tính oxi hóa.
2. Tính khử
Ở nhiệt độ khoảng 3000oC (hoặc nhiệt độ của lò hồ quang điện), nitơ kết hợp trực tiếp với oxi tạo ra khí nitơ monooxit (NO):

Đây là phản ứng thuận nghịch và thu nhiệt. Ở phản ứng này, số oxi hóa của nitơ tăng, nitơ thể hiện tính khử.
Trong thiên nhiên, khí NO được tạo thành khi có cơn giông.
Ở điều kiện thường, khí NO không màu kết hợp ngay với oxi trong không khí, tạo ra khí nitơ đioxit (NO2) màu nâu đỏ.
2NO+O2→2NO2
Các oxit khác của nitơ như N2O,N2O3,N2O5 không điều chế được từ phản ứng trực tiếp giữa nitơ và oxi.
IV - TRẠNG THÁI TỰ NHIÊN VÀ ĐIỀU CHẾ
1. Trạng thái tự nhiên
Trong tự nhiên, nitơ tồn tại ở trạng thái tự do và dạng hợp chất.
* Ở dạng tự do, nitơ chiếm khoảng 80% thể tích của không khí. Nitơ trong tự nhiên là hỗn hợp của hai đồng vị 147N(99,63%) và 157N(0,37%)
* Ở dạng hợp chất, nitơ có nhiều trong khoáng vật natri nitrat (NaNO3) với tên gọi là diêm tiêu natri. Nitơ còn có trong thành phần của protein, axit nucleic, ... và nhiều hợp chất hữu cơ khác.
2. Điều chế
a) Trong công nghiệp
Trong công nghiệp, nitơ được sản xuất bằng phương pháp chưng cất phân đoạn không khí lỏng. Sau khi đã loại bỏ tạp CO2 và hơi nước, không khí được hóa lỏng dưới áp suất cao và nhiệt độ thấp. Nâng dần nhiệt độ không khí lỏng đến −196oC thì nitơ sôi và được tách khỏi oxi lỏng vì oxi có nhiệt độ sôi cao hơn (−183oC). Khí nitơ được vận chuyển trong các bình thép, nén dưới áp suất 150atm.
b) Trong phòng thí nghiệm
Người ta điều chế một lượng nhỏ nitơ tinh khiết bằng cách đun nóng nhẹ dung dịch bão hòa muối amoni nitrit (muối amoni của axit nitrơ):
NH4NO2→to N2+2H2O
Có thể thay muối amoni nitrit kém bền bằng dung dịch bão hòa của muối natri nitrit (NaNO2) và muối clorua (NH4Cl):
NH4Cl+NaNO2→to N2+NaCl+2H2O
V- ỨNG DỤNG
Nguyên tố nitơ là một trong những thành phần dinh dưỡng chính của thực vật. Trong công nghiệp, phần lớn lượng nitơ sản xuất ra được dùng để tổng hợp amoniac, từ đó sản xuất phân đạm, axit nitric,... Nhiều ngành công nghiệp như luyên kim, thực phẩm, điện tử,... sử dụng nitơ làm môi trường trơ. Nitơ lỏng được dùng để bảo quản máu và các vật sinh học khác.