1. Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hóa học.
- Trong nhiều quá trình hóa học, các chất phản ứng có thể biến hóa hoàn toàn thành sản phẩm của phản ứng.
Ví dụ:
Khi được đốt nóng và có mặt chất xúc tác MnO2, muối KClO3 phân hủy hoàn toàn thành KCl và O2 theo phản ứng:
Nhưng KCl và O2 không thể kết hợp với nhau tạo thành KClO3. Những phản ứng chỉ xảy ra theo một chiều như vậy gọi là phản ứng một chiều.
- Phản ứng thuận nghịch là phản ứng ở cùng điều kiện có thể xảy ra theo hai chiều ngược nhau:
Ví dụ: Khi đun nóng bột sắt Fe3O4 tới 450oC, từ từ cho một luồng khí H2 đi qua t thu được bột sắt và hơi nước
Trái lại, ở cùng điều kiện khi ta cho hơi nước đi qua bột sắt nóng đỏ ở 450oC, ta lại thu được bột sắt từ oxit
Tóm lại, ở cùng điều kiện ta có hai phản ứng ngược chiều. Người ta thường viết phản ứng thuận nghịch này như sau:
- Đặc điểm của phản ứng thuận nghịch là không hoàn toàn.
- Một phản ứng thuận nghịch trước sau sẽ đạt trạng thái cân bằng: tại đó áp suất hơi của các chất khí (hoặc nồng độ mol của từng chất...) là không đổi.
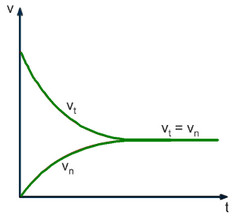
- Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. Cân bằng hóa học là cân bằng động
Đại lượng đặc trưng cho trạng thái cân bằng của một phản ứng thuận nghịch là hằng số cân bằng KC
2. Sự chuyển dịch cân bằng
Sự chuyển dịch cân bằng hóa học là sự di chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác do tác động của các yếu tố từ bên ngoài lên cân bằng.
Những yếu tố làm chuyển dịch cân bằng là nồng độ, áp suất và nhiệt độ. Chúng được gọi là các yếu tố ảnh hưởng đến cân bằng hóa học.
3. Các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học
a. Ảnh hưởng của nhiệt độ
Để nghiên cứu ảnh hưởng của nhiệt độ đến cân bằng hóa học cần biết khái niệm phản ứng tỏa nhiệt và phản ứng thu nhiệt.
Các phản ứng hóa học thường kèm sự giải phóng hoặc hấp thụ năng lượng dưới dạng nhiệt. Thí dụ, khi cho vôi sống (CaO) tác dụng với nước, ta thấy hỗn hợp tạo thành sôi lên. Phản ứng như thế là phản ứng tỏa nhiệt. Ngược lại, khi nung đá vôi (CaCO3) để sản xuất vôi sống, ta phải liên tục cung cấp nhiệt cho phản ứng. Đó là phản ứng thu nhiệt.
Để chỉ lượng nhiệt kèm theo mỗi phản ứng hóa học, người ta dùng đại lượng nhiệt phản ứng, kí hiệu là . Phản ứng tỏa nhiệt thì các chất phản ứng mất bớt năng lượng nên giá trị <0. Ngược lại, phản ứng thu nhiệt các chất phản ứng phải lấy thêm năng lượng để tạo ra các sản phẩm, nên giá trị .
Thí dụ:
Kết luận: Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng thu nhiệt, nghĩa là làm giảm tác động của việc tăng nhiệt độ và khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt, chiều làm giảm tác động của việc giảm nhiệt độ.
b. Ảnh hưởng của nồng độ
Xét hệ cân bằng sau trong một bình kín ở nhiệt độ cao không đổi:
Khi phản ứng đang ở trạng thái cân bằng, nghĩa là vt = vn, nồng độ các chất trong phản ứng không biến đổi nữa.
Nếu ta cho thêm vào hệ một lượng khí CO2, nồng độ CO2 trong hệ sẽ tăng lên làm cho ngay lúc đó vt trở nên lớn hơn vn, CO2 sẽ phản ứng thêm với C tạo ra CO cho đến khi vt lại bằng vn, lúc đó cân bằng mới được thiết lập. Ở trạng thái cân bằng mới, nồng độ các chất sẽ khác với ở trạng thái cân bằng cũ.
Vậy, khi thêm CO2 vào hệ cân bằng, cân bằng sẽ dịch chuyển theo chiều từ trái sang phải (theo chiều thuận), chiều làm giảm nồng độ CO2 thêm vào
Kết luận, khi tăng hoặc giảm nồng độ một chất trong cân bằng, thì cân bằng bao giờ cũng chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm nồng độ của chất đó.
Lưu ý rằng, nếu trong hệ cân bằng có chất rắn (ở dạng nguyên chất), thì việc thêm hoặc bớt lượng chất rắn không ảnh hưởng đến cân bằng, nghĩa là cân bằng không chuyển dịch.
c. Ảnh hưởng của áp suất
∙ Xét cân bằng sau:
N2O4(k) ⇌ 2NO2(k)
- Khi tăng áp suất thì cân bằng chuyển dịch theo chiều làm giảm áp suất.
- Khi giảm áp suất thì cân bằng chuyển dịch theo chiều làm tăng áp suất.
∙ Kết luận:
- Khi tăng hoặc giảm áp suất chung của hệ cân bằng thì cân bằng bao giờ cũng chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm áp suất đó.
- Lưu ý: Khi số mol khí ở 2 vế bằng nhau (hoặc phản ứng không có chất khí) thì áp suất không ảnh hưởng đến cân bằng.
Thí dụ:
H2(k)+I2(k)⇌2HI(k)
Fe2O3(r)+3CO(k)⇌2Fe(r)+3CO2(k)
∙ Kết luận:
- Nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
d. Vai trò của chất xúc tác
- Chất xúc tác không ảnh hưởng đến cân bằng hóa học.
- Vai trò chất xúc tác là làm tăng tốc độ phản ứng thuận và phản ứng nghịch với số lần bằng nhau.
- Khi chưa cân bằng thì chất xúc tác làm cho cân bằng thiết lập nhanh hơn.
4. Ý nghĩa của tốc độ phản ứng và cân bằng hóa học trong sản xuất
Xem xét một số thí dụ sau để thấy ý nghĩa của tốc độ phản ứng và cân bằng hóa học trong sản xuất hóa học:
∙ Thí dụ 1:
2SO2(k) + O2(k) ⇌ 2SO3(k) ΔH<0
- Ở nhiệt độ thường, phản ứng xảy ra chậm. Để tăng tốc độ phản ứng phải dùng chất xúc tác và tăng nhiệt độ. Nhưng đây là phản ứng tỏa nhiệt, nên khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch làm giảm hiệu suất phản ứng. Để hạn chế tác dụng này, người ta dùng một lượng dư không khí, nghĩa là tăng nồng độ oxi, làm cho cân bằng chuyển dịch theo chiều thuận.
∙ Thí dụ 2:
N2(k)+ 3H2(k) ⇌ 2NH3(k) ΔH<0
- Ở nhiệt độ thường, tốc độ phản ứng xảy ra rất chậm; nhưng ở nhiệt độ cao, cân bằng chuyển dịch theo chiều nghịch; do đó, phản ứng này phải được thực hiện ở nhiệt độ thích hợp, áp suất cao và dùng chất xúc tác.