A. AMONIAC
I. CẤU TẠO PHÂN TỬ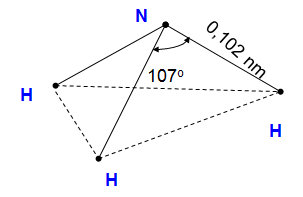
Trong phân tử amoiac:
N liên kết với H bằng liên kết cộng hóa trị có cực.
Có cấu tạo hình chóp với nguyên tử N ở đỉnh.
Nguyên tử N có cặp electron hóa trị tham gia liên kết với nguyên tử khác.
II. TÍNH CHẤT VẬT LÝ
- Là chất khí không màu, mùi khai, xốc, nhẹ hơn không khí
- Tan nhiều trong nước, tạo thành dd có tính kiềm
- Khí NH3 tan nhiều trong nước làm giảm P trong bình và nước bị hút vào bình. Phenolphtalein chuyển thành màu hồng ⇒ NH3 có tính bazơ.
- Dung dịch NH3 đậm đặc trong phòng thí nghiệm có nồng độ 25% (N = 0,91g/cm3).
III. TÍNH CHẤT HÓA HỌC
1.Tính bazơ yếu
a) Tác dụng với H2O giải phóng OH- và dẫn điện
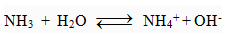
b) Tác dụng với dung dịch muối tạo thành kết tủa hiđroxit. Ví dụ
AlCl3 + 2NH3 + 3H2O → Al(OH)3↓+ 3NH4Cl
Al3++3NH3+3H2O → Al(OH)3 ↓ + 3NH4+
c) Tác dụng với axit tạo muối amoni
2NH3 + H2SO4 → (NH4)2SO4
NH3 + HCl → NH4Cl
2.Tính khử
Trong phân tử NH3 nguyên tử N có số oxi hóa là -3 là số oxi hóa thấp nhất vì vậy amoniac có tính khử.
a) Tác dụng với oxi: 4NH3 + 3O2 .png) 2N2 + 6H2O
2N2 + 6H2O
b)Tác dụng với clo: NH3 + 3Cl2 → N2 + 6HCl.
Kết luận: Amoniac có các tính chất hoá học cơ bản: Tính bazơ yếu và Tính khử
IV. ỨNG DỤNG
- Sản xuất HNO3
- Sản xuất phân đạm và dd NH3 có thể sử dụng trực tiếp làm phân bón
- Điều chế N2H4 làm nhiên liệu cho tên lửa
- NH3 lỏng dùng làm chất làm lạnh cho thiết bị lạnh
- Sử dụng trong công nghiệp đông lạnh (sản xuất nước đá, bảo quản nông phẩm...)
- Sử dụng trong công nghiệp môi trường (loại bỏ một số khí gây ô nhiễm như SO2...)
V. ĐIỀU CHẾ
1. Trong phòng thí nghiệm
- Đun nóng muối amoni với Ca(OH)2 hay dd kiềm: 2NH4Cl+Ca(OH)2 → CaCl2+2NH3↑+2H2O
- Để làm khô khí, ta cho khí NH3 có lẫn hơi nước qua bình vôi sống CaO.
- Điều chế nhanh 1 lượng nhỏ khí NH3, ta đun nóng dung dịch NH3 đậm đặc.
2. Trong công nghiệp
N2 + 3H2 ![]() 2NH3 △H<0
2NH3 △H<0
Nhiệt độ: 450 – 500oC
Áp suất: 200- 300 atm
Chất xúc tác: Fe/Al2O3, K2O
MUỐI AMONI
Muối amoni là chất tinh thể ion gồm cation amoni NH4+ và anion gốc axít. Ví dụ: NH4Cl, (NH4)2SO4, (NH4)2CO3
I. TÍNH CHẤT VẬT LÝ
Tất cả các muối amoni đều tan nhiều trong nước, khi tan điện li hoàn toàn tạo thành các ion. Ion NH4+ không màu
II. TÍNH CHẤT HÓA HỌC
1.Tác dụng với dung dịch kiềm
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3 + 2H2O.
Phương trình ion thu gọn: NH4+ + OH- → NH3 + H2O
2.Phản ứng nhiệt phân
Muối amoni tạo bởi axít không có tính oxi hoá: (HCl,H2CO3) → NH3
NH4Cl ![]() NH3 + HCl
NH3 + HCl
(NH4)2CO3 ![]() NH3 + NH4HCO3
NH3 + NH4HCO3
NH4HCO3 ![]() NH3 + CO2+ H2O
NH3 + CO2+ H2O
Muối amoni tạo bởi axít có tính oxi hoá: (HNO2, HNO3) → N2 , N2O
NH4NO2 ![]() N2 + 2H2O
N2 + 2H2O
NH4NO3 ![]() N2O + 2H2O
N2O + 2H2O