I- TÍNH CHẤT HÓA HỌC
1. Tính axit và ảnh hưởng của nhóm thế
Do mật độ electron ở nhóm OH dịch chuyển về phía nhóm C=O, nguyên tử H của nhóm OH trở nên linh động nên axit cacboxylic điện li không hoàn toàn trong nước theo cân bằng:
![]()
Ka là mức đo lực axit: Ka càng lớn thì axit càng mạnh và ngược lại. Lực axit của axit caboxylic phụ thuộc vào cấu tạo của nhóm nguyên tử liên kết với nhóm cacboxyl (kí hiệu chung là R).
Axit cacboxylic là những axit yếu. Tuy vậy, chúng có đầy đủ tính chất của một axit như : làm đỏ quỳ tím, tác dụng với kim loại giải phóng hiđro, phản ứng với bazơ, đẩy được axit yếu hơn ra khỏi muối.
* Trong các axit no đơn chức, axit fomic (R là H) mạnh hơn cả. Các nhóm ankyl đẩy electron về phía nhóm cacboxyl nên làm giảm lực axit:
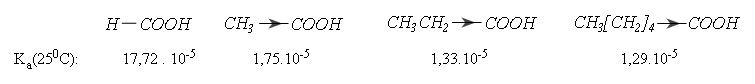
* Các nguyên tử có độ âm điện lớn ở gốc R hút electron của nhóm cacboxyl nên làm tăng lực axit.
Thí dụ:
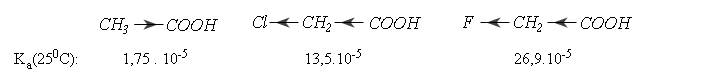
2. Phản ứng tạo thành dẫn xuất axit
a) Phản ứng với ancol (phản ứng este hóa)
* Thực nghiệm: Trong những bình thủy tinh hàn kín chứa hỗn hợp phản ứng, được đun nóng ở 800C. Sau phản ứng, chuẩn độ bằng dung dịch NaOH1M ta xác định được lượng axit axetic, từ đó tính được số mol este, nE, ở mỗi bình. Kết quả thực nghiệm được biểu diễn trên đồ thị ở hình dưới.
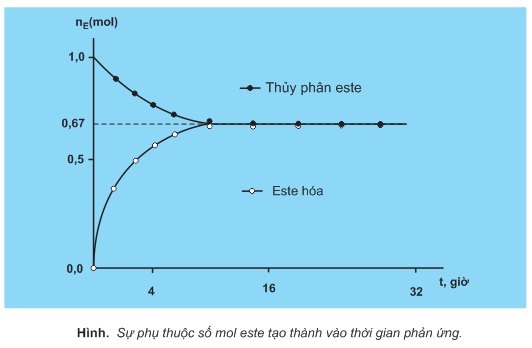
* Nhận xét: Phản ứng của 1 mol axit axetic và 1 mol ancol etylic (xúc tác axit) đạt tới giới hạn là tạo ra 2/3 mol este, còn dư 1/3 mol axit axetic và 1/3 mol ancol etylic. Khi xuất phát từ 1 mol este, tức là cũng đạt tới giới hạn trên.
* Kết luận: Phản ứng của axit axetic với etanol xúc tác axit là phản ứng thuận nghịch
CH3−CO−OH + C2H5−O−H⇌CH3−CO−OC2H5+H2O
axit axetic etanol etyl axetat
Một cách tổng quát, phản ứng giữa axit cacboxylic và ancol được viết như sau:
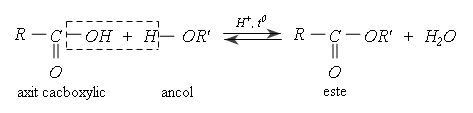
Chiều thuận là phản ứng este hóa, chiều nghịch là phản ứng thủy phân este.
b) Phản ứng tách nước liên phân tử
Khi cho tác dụng với P2O5, hai phân tử axit tách đi một phân tử nước tạo thành phân tử anhiđrit axit. Thí dụ:
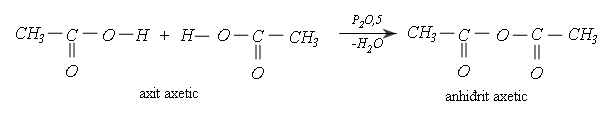
3. Phản ứng ở gốc hiđrocacbon
a) Phản ứng thế ở gốc no
Khi dùng photpho (P) làm xúc tác, Cl chỉ thế cho H ở cacbon bên cạnh nhóm cacboxyl. Thí dụ:
CH3CH2CH2COOH+Cl2→ (P) CH3CH2−CHCl−COOH+HCl
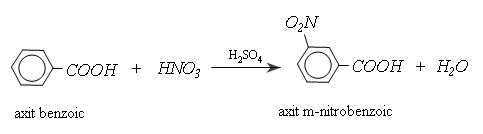
b) Phản ứng thế ở gốc thơm
Nhóm cacboxyl ở vòng benzen định hường cho phản ứng thế tiếp theo vào vị trí meta và làm cho phản ứng khó khăn hơn so với thế vào benzen:
c) Phản ứng cộng vào gốc không no
Axit không no tham gia phản ứng cộng H2,Br2,Cl2... như hiđrocacbon không no.
Thí dụ:
.png)
II- ĐIỀU CHẾ VÀ ỨNG DỤNG
1. Điều chế
a) Trong phòng thí nghiệm
* Oxi hóa hiđrocacbon , ancol,...:
C6H5−CH3→(H2O,to KMnO4) C6H5COOK→(H3O+) C6H5−COOH
* Đi từ dẫn xuất halogen:
R−X→(KCN) R−C≡N→(H3O+,to) R−COOH
b) Trong công nghiệp
Axit axetic được sản xuất theo các phương pháp sau.
* Lên men giấm là phương pháp cổ nhất, ngày nay chỉ còn dùng để sản xuất giấm ăn:
CH3CH2OH+O2→(25−30oC mengiấm) CH3COOH+H2O
* Oxi hóa anđehit axetic trước đây là phương pháp chủ yếu sản xuất axit axetic:
CH3CH=O+1/2 O2→xt,to CH3COOH
* Đi từ metanol và các cacbon oxit, nhờ xúc tác thích hợp là phương pháp hiện đại sản xuất axit axetic:
CH3OH+CO→xt,to CH3COOH
Vì metanol và cacbon oxit đều được điều chế từ metan có sẵn trong khí thiên nhiên và khí dầu mỏ nên phương pháp này do axit axetic với giá hạ nhất.
2. Ứng dụng
a) Axit axetic
Axit axetic được dùng để điều chế những chất có ứng dụng quan trọng như: axit cloaxetic (dùng tổng hợp chất diệt cỏ 2,4−D;2,4,5−T...), muối axetat của nhôm, crom, sắt (dùng làm chất cầm màu khi nhuộm vải, sợi), một số este (làm dược liệu, hương liệu, dung môi,...), xenlulozơ axetat (chế tơ axetat),...
b) Các axit khác
Các axit béo như axit panmitic (C15H31COOH), axit stearic (C17H35COOH),... được dùng để chế xà phòng. Axit benzoic được dùng trong tổng hợp phẩm nhuộm, nông dược,... Axit salixylic dùng để chế thuốc cảm, thuốc xoa bóp, giảm đau,...
Các axit đicacboxylic (như axit ađipic, axit phtalic,...) được dùng trong sản xuất poliamit, polieste để chế tơ sợi tổng hợp.