I- VỊ TRÍ VÀ CẤU TẠO
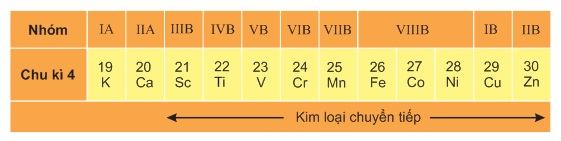
1. Vị trí của sắt trong bảng tuần hoàn
Sắt là nguyên tố kim loại chuyển tiếp, thuộc nhóm VIIIB, chu kì 4, số hiệu nguyên tử là 26.
2. Cấu tạo của sắt
- Cấu hình electron
Nguyên tử Fe có 26 electron, được phân bố thành 4 lớp: 2e,8e,14e,2e.
Sắt là nguyên tố d, có cấu hình electron nguyên tử: 1s22s22p63s23p63d64s2 hay viết gọn là:
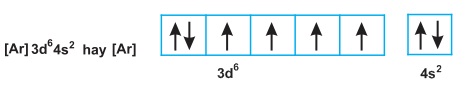
Khi tạo ra các ion sắt, nguyên tử Fe nhường electron ở phân lớp 4s trước phân lớp 3d. Thí dụ:
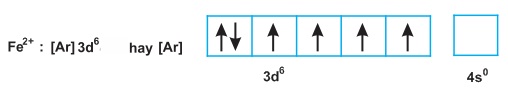
Nguyên tử Fe nhường 2e ở phân lớp 4s tạo ra ion Fe2+, có cấu hình electron:
Nguyên tử Fe nhường 2e ở phân lớp 4s và 1e ở phân lớp 3d tạo ra ion Fe3+, có cấu hình electron:
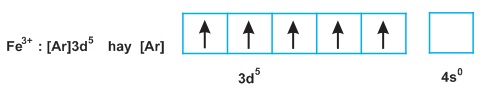
Nhận xét: Tương tự nguyên tố Cr, khi tham gia phản ứng hóa học, nguyên tử Fe không chỉ nhường electron ở phân lớp 4s mà có thể nhường thêm electron ở phân lớp 3d, tạo ra những ion có điện tích khác nhau là Fe2+ và Fe3+. Trong hợp chất, Fe có số oxi hóa +2 hoặc +3.
- Một số đại lượng của nguyên tử
Bán kính nguyên tử Fe: 0,162(nm)
Bán kính các ion Fe2+ và Fe3+: 0,076 và 0,064(nm)
Năng lượng ion hóa I1, I2 và I3: 760,1560,2960(kJ/mol)
Độ âm điện :1,83
Thế điện cực chuẩn E0Fe2+/Fe:−0,44(V) E0Fe3+/Fe2+:+0,77(V)
- Cấu tạo của đơn chất
Tùy thuộc vào nhiệt độ, kim loại Fe có thể tồn tại ở các mạng tinh thể lập phương tâm khối (Feα) hoặc lập phương tâm diện (Feγ).
II- TÍNH CHẤT VẬT LÍ.
Sắt là kim loại có màu trắng hơi xám, dẻo, dễ rèn, nóng chảy ở nhiệt độ 1540oC, có khối lượng riêng 7,9g/cm3. Sắt có tính dẫn điện, dẫn nhiệt tốt, đặc biệt có tính nhiễm từ.
III- TÍNH CHẤT HÓA HỌC
Những đặc điểm về cấu tạo và đại lượng đặc trưng của nguyên tử Fe nêu ở trên cho thấy tính chất hóa học cơ bản của sắt là tính khử trung bình: Fe có thể bị oxi hóa thành Fe2+ hoặc Fe3+.
1. Tác dụng với phi kim
Fe khử nhiều phi kim thành ion âm trong khi đó Fe bị oxi hóa thành Fe2+ thành Fe3+.
Thí dụ:
Fe+S→to FeS
3Fe+2O2 → to Fe3O4
2Fe+3Cl2→to 2FeCl3
2. Tác dụng với axit
Fe khử dễ dàng ion H+ trong dung dịch axit HCl hoặc H2SO4 loãng thành hiđro đồng thời Fe bị oxi hóa thành Fe2+:
Fe+H2SO4→FeSO4+H2↑
Khi tác dụng với những axit có tính oxi hóa mạnh, như HNO3 và H2SO4 đặc nóng, Fe bị oxi hóa mạnh thành ion Fe3+
Fe+4HNO3(loãng)→Fe(NO3)3+2H2O+NO↑
2Fe+6H2SO4(đặc)→to Fe2(SO4)3+6H2O+3SO2↑
Axit HNO3 và H2SO4 đặc nguội không tác dụng với sắt mà còn làm cho sắt trở nên thụ động.
3. Tác dụng với dung dịch muối
Sắt khử được những ion kim loại đứng sau nó trong dãy điện hóa (có thế điện cực chuẩn lớn hơn −0,44V ).
Thí dụ:
Fe+CuSO4→FeSO4+Cu↓
Fe+3AgNO3(dư)→Fe(NO3)3+3Ag↓

4. Tác dụng với nước
Ở nhiệt độ cao, sắt khử được hơi nước
3Fe+4H2O→to<570oC Fe3O4+4H2↑
Fe+H2O→to>570oC FeO+H2↑
IV- TRẠNG THÁI TỰ NHIÊN
Trong tự nhiên, sắt ở trạng thái tự do trong các mảnh thiên thạch. Những hợp chất của sắt tồn tại dưới dạng quặng sắt thì rất phong phú (sắt chiếm tới 5% khối lượng vỏ Trái Đất, đứng hàng thứ tư trong các nguyên tố, hàng thứ hai trong các kim loại, sau nhôm). Một số quặng sắt quan trọng là:
Quặng hematit đỏ chứa Fe2O3 khan.
Quặng hematit nâu chứa Fe2O3.nH2O
Quặng manhetit chứa Fe3O4 là quặng giàu sắt nhất, nhưng hiếm có trong tự nhiên.
Ngoài ra còn có quặng xiđerit chứa FeCO3, quặng pirit sắt chứa FeS2.
Để sản xuất gang người ta thường dùng manđetit và hemantit.
Hợp chất sắt còn có mặt trong hồng cầu của máu, làm nhiệm vụ chuyển tải oxi đến các tế bào cơ thể để duy trì sự sống của con người và động vật.