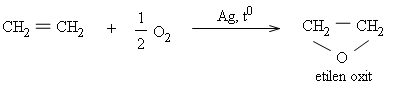I- TÍNH CHẤT VẬT LÍ
1. Nhiệt độ sôi, nhiệt độ nóng chảy và khối lượng riêng
Bảng 6.1: Hằng số vật lí của một số anken
.png)
Nhận xét: Nhiệt độ sôi, nhiệt độ nóng chảy và khối lượng riêng của anken không khác nhiều so với ankan tương ứng và thường nhỏ hơn xicloankan có cùng số nguyên tử C. Ở điều kiện thường, anken từ C2 đến C4 là chất khí. Nhiệt độ sôi, nhiệt độ nóng chảy tăng theo khối lượng mol phân tử. Các anken đều nhẹ hơn nước.
2. Tính tan và màu sắc
Anken hoà tan tốt trong dầu mỡ. Anken hầu như không tan trong nước và là những chất không màu.
II - TÍNH CHẤT HOÁ HỌC
Liên kết π ở nối đôi của anken kém bền vững, nên trong phản ứng dễ bị đứt ra để tạo thành kiên kết σ với các nguyên tử khác. Vì thế, liên kết đôi C=C là trung tâm phản ứng gây ra những phản ứng hoá học đặc trưng cho anken như phản ứng cộng, phản ứng trùng hợp và phản ứng oxi hoá.
1. Phản ứng cộng hiđro (phản ứng hiđro hoá)
Khi có mặt chất xúc tác như Ni,Pt,Pd, ở nhiệt độ thích hợp, anken cộng hiđro vào nối đôi tạo thành ankan tương ứng, phản ứng toả nhiệt, thí dụ:
CH2=CH2+H2→−xt,to CH3−CH3
R1R2C=CR3R4+H2→xt,to R1R2CH−CHR3R4
2. Phản ứng cộng halogen (phản ứng halogen hoá)
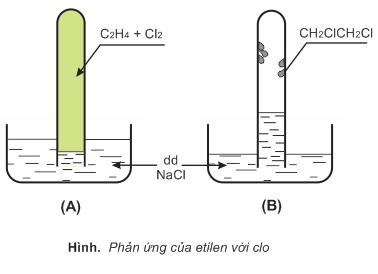
a) Cộng clo
Etilen và clo đều ít tan trong dung dịch natri clorua. Thoạt đầu mức nước trong ống nghiệm thấp (A). Etilen cộng với clo tạo thành chất lỏng dạng dầu, không tan trong nước, bám vào thành ống nghiệm, áp suất trong ống nghiệm giảm làm cho mức nước nâng lên (B).
CH2=CH2+Cl2→ClCH2−CH2Cl(1,2−đicloetan,ts:83,5oC)
b) Cộng brom
Cho 0,2ml anken lỏng, chẳng hạn hex−2−en, vào ống nghiệm chứa 2ml nước brom, lắc kĩ rồi để yên, màu vàng - da cam của nước brom bị mất.
Brom dễ cộng vào nối đôi của anken tạo thành dẫn xuất đihalogen không màu:
CH3CH=CHCH2CH2CH3+Br2→CH3CHBr−CHBrCH2CH2CH3 (2,3 - đibromhexan)
Anken làm mất màu của nước brom, vì thế người ta thường dùng nước brom hoặc dung dịch brom trong CCl4 làm thuốc thử để nhận biết anken.
3. Phản ứng cộng axit và cộng nước
a) Cộng axit
Hiđro halogenua (HCl,HBr,HI), axit sunfuric đậm đặc, ... có thể cộng vào anken.
Thí dụ: CH2=CH2+H−Cl(khí)→CH3CH2Cl (etyl clorua)
CH2=CH2+H−OSO3H→CH3CH2OSO3H (etyl hiđrosunfat)
Cơ chế phản ứng cộng axit vào anken Axit cộng vào anken theo sơ đồ chung: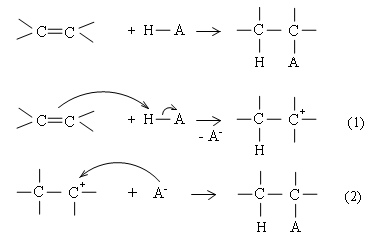
Phản ứng xảy ra qua 2 giai đoạn liên tiếp:
Phản ứng H−A bị phân cắt dị li: H+ tương tác với liên kết π tạo thành cacbocation, còn A− tách ra.
Cacbocation là tiểu phân trung gian không bền, kết hợp ngay với anion A− tạo sản phẩm.
b) Cộng nước (phản ứng hiđrat hoá)
Ở nhiệt độ thích hợp và có xúc tác axit, anken có thể cộng nước, thí dụ:
CH2=CH2+H−OH→H+,to HCH2−CH2OH (etanol)
c) Hướng của phản ứng cộng axit và nước vào anken
Phản ứng cộng axit hoặc nước vào anken không đối xứng thường tạo ra hỗn hợp hai đồng phân, trong đó có một đồng phân là sản phẩm chính. Thí dụ
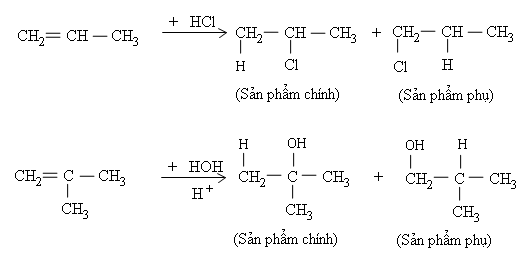
Quy tắc Mac-côp-nhi-côp:
Trong phản ứng cộng axit hoặc nước (kí hiệu chung là HA) vào liên kết C=C của anken, H (phần tử mang điện tích dương) ưu tiên cộng vào C mang nhiều H hơn (cacbon bậc thấp hơn), còn A (phần tử mang điện tích âm) ưu tiên cộng vào C mang ít H hơn (cacbon bậc cao hơn).
4. Phản ứng trùng hợp
Các anken ở đầu dãy như etilen, propilen, butilen trong những điều kiện nhiệt độ, áp suất, xúc tác thích hợp thì tham gia phản ứng cộng nhiều phân tử với nhau thành những phân tử mạch rất dài và có khối lượng phân tử lớn. Người ta gọi đó là phản ứng trùng hợp. Thí dụ:
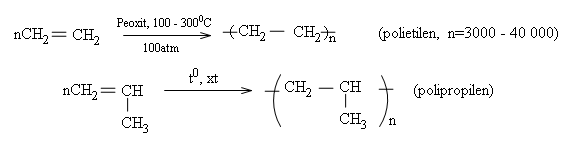
Phản ứng trùng hợp là quá trình kết hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau thành những phân tử rất lớn gọi là polime.
Trong phản ứng trùng hợp, chất đầu (các phân tử nhỏ) được gọi là monome. Sản phẩm của phản ứng gồm nhiều mắc xích monome hợp thành nên được gọi là polime. Số lượng mắc xích monome trong một phân tử polime gọi là hệ số trùng hợp và kí hiệu là n.
5. Phản ứng oxi hoá
Giống với ankan, anken cháy hoàn toàn tạo ra CO2,H2O và toả nhiều nhiệt:
CnH2n+3n/2 O2→nCO2+nH2O;ΔH<0
Khác với ankan, anken làm mất màu dung dịch KMnO4:
3CH2=CH2+2KMnO4+4H2O→3HOCH2−CH2OH+2MnO2+2KOH
(etylen glicol)
Phản ứng làm mất màu tím của dung dịch kali penmanganat được dùng để nhận ra sự có mặt của liên kết đôi anken.
III- ĐIỀU CHẾ VÀ ỨNG DỤNG
1. Điều chế
Trong công nghiệp, etilen, propilen và butilen được điều chế bằng phản ứng tách hiđro từ ankan tương ứng bằng phản ứng crăckinh.
Trong phòng thí nghiệm, etilen đuợc điều chế bằng cách đun etanol với axit sunfuric đậm đặc:
CH3CH2OH→(H2SO4,170oC) CH2=CH2+H2O
2. Ứng dụng
Trong các hoá chất hữu cơ do con người sản xuất ra thì etilen đứng hàng đầu về sản lượng. Sở dĩ như vậy vì etilen cũng như các anken thấp khác là nguyên liệu quan trọng của công nghiệp tổng hợp polime và các hoá chất hữu cơ khác.
a) Tổng hợp polime
* Trùng hợp etilen, propilen, butilen người ta thu được các polime để chế tạo màng mỏng, bình chứa, ống dẫn nướcm,... dùng cho nhiều mục đích khác nhau.
* Chuyển hoá etilen thành các monome khác để tổng hợp ra hàng loạt polime đáp ứng nhu cầu phong phú của đời sống và kĩ thuật. Thí dụ:
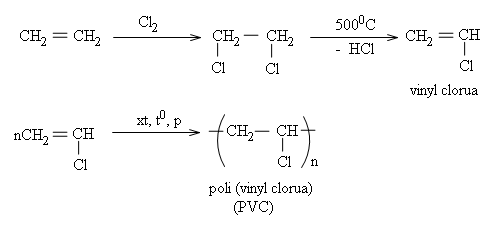
b) Tổng hợp các hoá chất khác
Từ etilen tổng hợp ra những hoá chất hữu cơ thiết yếu như etanol, etilen oxit, etylen glicol, anđehit axetic,...