I. SỰ CHUYỂN ĐỘNG CỦA CÁC ELECTRON TRONG NGUYÊN TỬ
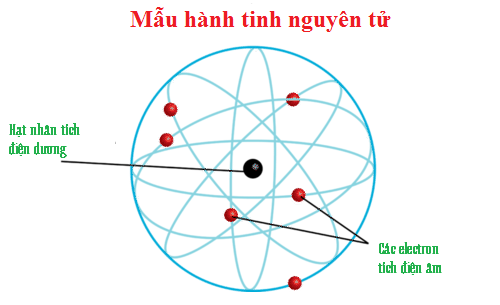
Những năm đầu của thế kỉ XX. người ta cho rằng các electron chuyển động xung quanh hạt nhân nsuyên tử theo những quỹ đạo tròn hay bầu dục, như quỹ đạo của các hành tinh quay xung quanh Mặt Trời. Đó là mô hình mẫu hành tinh nguyên tử của Rơ-dơ-pho, Bo (N.Bohr) và Zom-mơ-phen (A.Sommeríeld).
Mô hình này có tác dụng rất lớn đến sự phát triển lí thuyết cấu lạo nguyên tử, nhưng không đầy đủ để giải thích mọi tính chất của nguyên tử.
Ngày nay, người ta đã biết các electron chuvển động rất nhanh (tốc độ hàng nghìn km/s) trong khu vực xung quanh hạt nhãn
nguyên tử không theo những quỹ đạo xác định(l) tạo nên vỏ nguyên tứ Số electron ở vỏ nguyên tử của một nguyên tô' đúng bằng số proton trong hạt nhân nguyên tử và cũng bằng sô' hiệu 112uyên tử (Z) hay sô' thứ tự của neuyên tố đó irons bảng tuần hoàn. Chẳng hạn, vỏ của nguvên tử hiđro (Z = 1) có 1 electron, vỏ của nauyên tử cio (Z = 17) có 17 electron, vỏ của neuyên tử vàng (Z = 79) có tới 79 electron,... Vậy các electron được phân bố như thế nào ?
Các kết quả nghiên cứu cho thấy chúng phải phân bố theo những quy luật nhất định.
II. LỚP ELECTRON VÀ PHÂN LỚP ELECTRON
a) Lớp electron
Các electron trong nguyên tử ờ trạng thái cơ bản lần lượt chiếm các mức năng lượng từ thấp đến cao và sắp xếp thành từng lớp. Các electron ở gần nhân hơn liên kết bền chặt hơn với hạt nhân. Vì vậy, electron ở lớp trong có mức năng lượng thấp hơn so với ở các lớp ngoài.
Các electron trên cùng một lớp có mức náng lượng gần bằng nhau.
Xếp theo thứ tự mức nãng lượng từ thấp đến cao, các lớp electron này được ghi bằng các số nguyên theo thứ tự n = 1, 2, 3,4 ... với tên gọi: K, L, M, N,...
n= 1 2 3 4...
Tên lớp K L M N
b) Phân lớp electron
Mỗi lớp electron lại chia thành các phân lớp.
Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
Các phân lớp được kí hiệu bàng các chữ cái thường s, p, d, f.
Số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó.
Lớp thứ nhất (lớp K, n = 1) có một phân lớp, đó là phân lớp 1s ;
Lớp thứ hai (lớp L, n = 2) có hai phân lớp, đó là các phân lớp 2s và 2p ;
Lớp thứ ba (lớp M, n = 3) có ba phân lớp, đó là các phân lớp 3s, 3p và 3d ; v.v...
Các electron ờ phân lớp s được gọi là các electron s, ở phân lớp p được gọi là các electron p...
III. SỐ ELECTRON TỐI ĐA TRONG MỘT PHÂN LỚP, MỘT LỚP
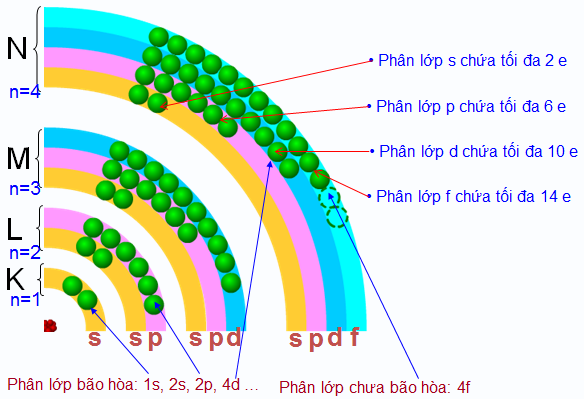
Số electron tối đa trong một phân lớp như sau :
- Phân lớp s chứa tối đa 2 electron ;
- Phản lớp p chứa tối đa 6 electron ;
- Phân lớp d chứa tối đa 10 electron ;
- Phân lớp f chứa tối đa 14 electron ;
Phân lớp electron đã có đủ số electron tối đa gọi là phân lớp electron bão hoà. Từ đó suy ra số electron tối đa trong một lớp :
- Lớp thứ nhất (lớp K, n = 1) có 1 phân lớp ls, chứa tối đa 2 electron.
- Lớp thứ hai (lớp L, n = 2) có 2 phân lớp 2s và 2p :
+ Phân lớp 2s chứa tối đa 2 electron ;
+ Phân lớp 2p chứa tối đa 6 electron ;
Vậy, lớp thứ hai chứa tối đa 8 electron.
- Lớp thứ ba (lớn M, n=3) có 3 phân lớp 3s, 3p, 3d
+ Phân lớp 3s chứa tối đa 2 electron ;
+ Phân lớp 3p chứa tối đa 6 electron ;
+ Phân lớp 3d chứa tối đa 10 electron ;
Vậy, lớp thứ ba chứa tối đa 18 electron