I- NHÔM OXIT
1. Tính chất vật lý và trạng thái tự nhiên
Nhôm oxit là chất rắn màu trắng, không tác dụng với nước và không tan trong nước. Nóng chảy ở 2050oC.
Trong tự nhiên, nhôm oxit tồn tại cả ở dạng ngậm nước và dạng khan: Dạng ngậm nước như boxit Al2O3.2H2O là nguyên liệu quan trọng để sản xuất nhôm. Dạng khan như như emeri, có độ cứng cao, dùng làm đá mài. Corinđon là ngọc thạch rất cứng, cấu tạo tinh thể trong suốt, không màu. Corinđon thường có màu là do lẫn một số tạp chất oxit kim loại. Nếu tạp chất là Cr2O3, ngọc có màu đỏ tên là rubi, nếu tạp chất là TiO2 và Fe3O4, ngọc có màu xanh tên là saphia. Rubi và saphia nhân tạo được chế tạo bằng cách nung nóng hỗn hợp nhôm oxit với Cr2O3 hoặc TiO2 và Fe3O4.
2. Tính chất hóa học
a) Tính bền
Ion Al3+ có điện tích lớn (3+) và bán kính ion nhỏ (0,048nm) bằng 1/2 bán kính ion Na2+ hoặc 2/3 bán kính ion Mg2+ nên lực hút giữa ion Al3+ và ion O2− rất mạnh, tạo nên liên kết rất bền vững. Do cấu trúc này mà Al2O3 có nhiệt độ nóng chảy rất cao (2050oC) và khó bị khử thành kim loại Al.
b) Tính lưỡng tính
Al2O3 có tính lưỡng tính: tác dụng được với dung dịch axit và dung dịch kiềm. Al2O3 thể hiện tính bazơ.
Al2O3+6HCl→2AlCl3+3H2O
Al2O3+6H+→2Al3++3H2O
Al2O3 thể hiện tính axit:
Al2O3+2NaOH+3H2O→2Na[Al(OH)4]
Al2O3+2OH−+3H2O→2[Al(OH)4]−
c) Ứng dụng
Tinh thể Al2O3 (corinđon) được dùng làm đồ trang sức, chế tạo các chi tiết trong các ngành kĩ thuật chính xác, như chân kính đồng hồ, thiết bị phát tia laze,...
Bột Al2O3 có độ cứng cao được dùng làm vật liệu mài.
Boxit Al2O3.2H2Olà nguyên liệu sản xuất nhôm kim loại.
II- NHÔM HIĐROXIT
1. Tính chất hóa học
a) Tính không bền với nhiệt
Nhôm hiđroxit (Al(OH)3) là hợp chất không bền đối với nhiệt, khi đun nóng bị phân hủy thành nhôm oxit:
2Al(OH)3→to Al2O3+3H2O
b) Tính lưỡng tính
- Thí nghiệm 1: Thả một ít Al(OH)3 vừa được điều chế vào cốc nước, nhỏ vài giọt dung dịch HCl vào Al(OH)3
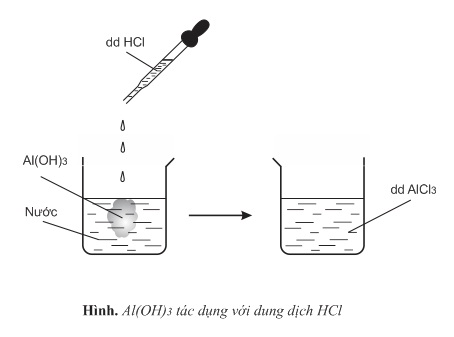
Nhận xét: Khi tác dụng với axit mạnh, Al(OH)3 thể hiện tính bazơ
Al(OH)3+3HCl→AlCl3+3H2O
Al(OH)3+3H+→Al3++3H2O
- Thí nghiệm 2: Thả một ít Al(OH)3 vào cốc nước, nhỏ vài giọt dung dịch kiềm (như NaOH,KOH,...) vào Al(OH)3
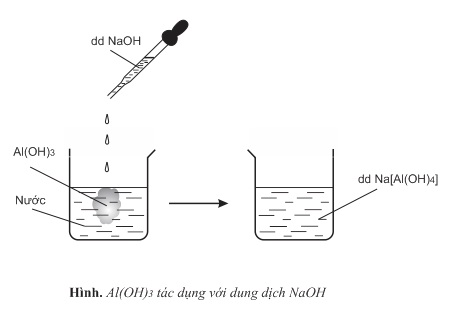
Nhận xét: Khi tác dụng với kiềm, Al(OH)3 thể hiện tính axit
Al(OH)3+NaOH→Na[Al(OH)4]
Al(OH)3+OH−→[Al(OH)4]−
Kết luận: Al(OH)3 là hiđroxit lưỡng tính.
III- NHÔM SUNFAT
Muối nhôm có nhiều ứng dụng quan trọng là muối sunfat kép kali và nhôm ngậm nước, trên thị trường có tên là phèn chua. Công thức hóa học là K2SO4.Al2(SO4)3.24H2O, viết gọn là KAl(SO4)2.12H2O. Trong công thức hóa học trên, nếu thay ion K+ bằng Li+,Na+ hay NH+4 ta được các muối kép khác có tên chung là phèn nhôm (không gọi là phèn chua).
Phèn chua được dùng trong ngành thuộc da, công nghiệp giấy (làm cho giấy không thấm nước), chất cầm màu trong công nghiệp nhuộm vải, chất làm trong nước đục,...
IV- CÁCH NHẬN BIẾT ION Al3+ TRONG DUNG DỊCH
Cho từ từ dung dịch NaOH đến dư vào dung dịch thí nghiệm, nếu thấy có kết tủa keo xuất hiện rồi tan trong NaOH dư thì chứng tỏ có ion Al3+.
Al3++3OH−→Al(OH)3↓
Al(OH)3+OH−(dư)→[Al(OH)4]−