I. HỢP CHẤT SẮT(II)
Tính chất hóa học đặc trưng của hợp chất sắt(II) là tính khử Fe2+ thành Fe3+.
1. Sắt(II) oxit(FeO)
FeO là chất rắn màu đen, không có trong tự nhiên; FeO tác dụng với dung dịch HNO3 được muối sắt(III):
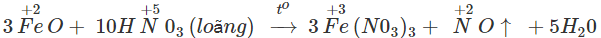
Sắt(II) oxit có thể điều chế bằng cách dùng H2 hay CO khử sắt(III) oxit ở 500°C.
2. Sắt(II) hiđroxit (Fe(OH)2)
Fe(OH)2 nguyên chất là chất rắn, màu trắng hơi xanh, không tan trong nước. Trong không khí, Fe(OH)2 dễ bị oxi hóa thành Fe(OH)3 màu nâu đỏ. Do đó muốn có Fe(OH)2 tinh khiết phải điều chế trong điều kiện không có không khí.
3. Muối sắt(II)
Đa số muối sắt(II) tan trong nước, khi kết tinh thường ở dạng ngậm nước. Thí dụ: FeSO4.7H2O; FeCl2.4H2O.
Muối sắt(II) dễ bị oxi hóa thành muối sắt(III) bởi các chất oxi hóa.
Muối sắt(II) được điều chế bằng cách cho Fe (hoặc FeO; Fe(OH)2) tác dụng với axit HCl hoặc H2SO4 loãng.
II. HỢP CHẤT SẮT(III)
Tính chất hóa học đặc trưng của hợp chất sắt(III) là tính oxi hóa.
1. Sắt(III) oxit (Fe2O3)
Fe2O3 là chất rắn màu đỏ nâu, không tan trong nước.
Fe2O3 là oxit bazơ nên dễ tan trong các dung dịch axit mạnh.
Ở nhiệt độ cao, Fe2O3 bị CO hoặc H khử thành Fe.
Fe2O3 có thể điều chế bằng phản ứng phân hủy Fe(OH)3 ở nhiệt độ cao.
Fe2O3 có trong tự nhiên dưới dạng quặng hematit dùng để luyện gang.
2. Sắt(III) hiđroxit (Fe(OH)3)
Fe(OH)3 là chất rắn, màu nâu đỏ, không tan trong nước nhưng dễ tan trong dung dịch axit tạo thành dung dịch muối sắt(III).
Sắt(III) hiđroxit được điều chế bằng cách cho dung dịch kiềm tác dụng với dung dịch muối sắt(III).
3. Muối sắt(III)
Đa số muối sắt(III) tan trong nước, khi kết tinh thường ở dạng ngậm nước. Thí dụ: FeCl3.6H2O; Fe2(SO4)3.9H2O
Các muối sắt(III) có tính oxi hóa, dễ bị khử thành muối sắt(II).