I - KHÁI NIỆM VỀ SỰ LAI HÓA
Để hiểu được khái niệm về sự lai hóa các obitan, ta xét liên kết trong phân tử CH4. Công thức cấu tạo:
Cấu hình electron nguyên tử C (ở trạng thái kích thích):
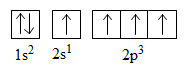
Trong phân tử CH4 có 4 liên kết C−H tạo thành bởi 4 obitan hóa trị (mỗi obitan có một electron độc thân) của nguyên tử C (một obitan 2s và ba obitan 2p) xen phủ với 4 obitan 1s của 4 nguyên tử H. Như vậy đáng lẽ trong phân tử CH4 phải có 2 loại liên kết khác nhau là: 1 liên kết s−s và 3 liên kết p−s. Tuy nhiên thực nghiệm cho biết 4 liên kết C−H trong phân tử CH4 giống hệt nhau có góc liên kết là 109o28'
Để giải thích trường hợp trên đây và các trường hợp tương tự, các nhà hóa học Mĩ Slây-tơ (J.Staler) và Pau-linh đã đề ra thuyết lai hóa.
Theo thuyết này, khi nguyên tử C tham gia liên kết với bồn nguyên tử H tạo thành phân tử CH4 thì obitan 2s đã tổ hợp "trộn lẫn" với ba obitan 2p tạo thành bốn obitan mới giống hệt nhau.
Như vậy: Sự lai hóa obitan nguyên tử là sự tổ hợp "trộn lẫn" một số obitan trong một nguyên tử để được từng ấy obitan lai hóa giống nhau nhưng định hướng khác nhau trong không gian.
Nguyên nhân của sự lai hóa là các obitan hóa trị ở các phân lớp khác nhau có năng lượng và hình dạng khác nhau cần phải đồng nhất để tạo được liên kết bền với các nguyên tử khác.
II - CÁC KIỂU LAI HÓA THƯỜNG GẶP
1. Lai hóa sp
Lai hóa sp là sự tổ hợp 1 obitan s với 1 obitan p của một nguyên tử tham gia liên kết tạo thành 2 obitan lai hóa sp nằm thẳng hàng với nhau về 2 phía, đối xứng nhau (hình 3.6).

Lai hóa sp được gặp trong phân tử BeH2 (hình 3.7) và trong các phân tử C2H2,BeCl2,...

Như thế, sự lai hóa sp là nguyên nhân dẫn đến tính thẳng hàng (góc liên kết bằng 1800) của các liên kết trong những phân tử nêu trên.
2. Lai hóa sp2
Lai hóa sp2 là sự tổ hợp 1 obitan s với 2 obitan p của một nguyên tử tham gia liên kết tạo thành 3 obitan lai hóa sp2 nằm trong một mặt phẳng, định hướng từ tâm đến đỉnh của tam giác đều. lai hóa sp2 được gặp trong các phân tử BF3 (hình 3.8),C2H4,...

Sự lai hóa sp2 là nguyên nhân dẫn đến các góc liên kết phẳng 1200 trong BF3.
3. Lai hóa sp3
Lai hóa sp3 là sự tổ hợp 1 obitan s với 3 obitan p của một nguyên tử tham gia liên kết tạo thành 4 obitan lai hóa sp3 định hướng tử tâm đến 4 đỉnh của hình tứ diện đều, các trục đối xứng của chúng tạo với nhau một góc109o28' (hình 3.9).
Lai hóa sp3 được gặp ở các nguyên tử O,N,C nằm trong các phân tử H2O,NH3,CH4 và ankan.

Chú ý: Các obitan chỉ lai hóa được với nhau khi năng lượng của chúng xấp xỉ bằng nhau.
III - NHẬN XÉT CHUNG VỀ LAI HÓA
Thuyết lai hóa có vai trò giải thích hơn là tiên đoán dạng hình học của phân tử. Thường chỉ sau khi biết phân tử có dạng hình học gì, có những góc liên kết xác định được bằng thực nghiệm là bao nhiêu, mới dùng sự lai hóa để giải thích. Nếu cho một phân tử hay ion, chẳng hạn AB4 mà không có dữ kiện nào, thì thuyết lai hóa sẽ không tiên đoán được là có sự lai hóa tứ diện hay vuông phẳng.
IV - SỰ XEN PHỦ TRỤC VÀ XEN PHỦ BÊN
1. Sự xen phủ truc
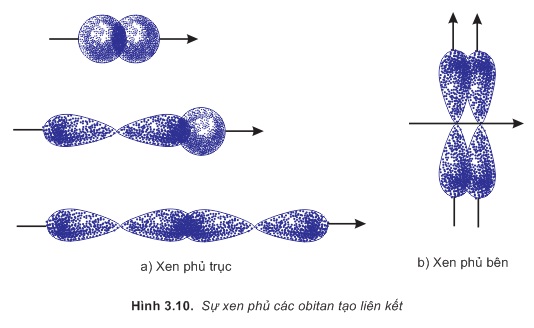
Sự xen phủ trong đó trục của các obiatn tham gia liên kết trùng với đường nối tâm của hai nguyên tử liên kết được gọi là sự xen phủ trục. Sự xen phủ trục tạo liên kết σ (hình 3.10a).
2. Sự xen phủ bên
Sự xen phủ trong đó trục của các obitan tham gia liên kết song song với nhau và vuông góc với đường nối tâm của hai nguyên tử liên kết được gọi là sự xen phủ bên. Sự xen phủ bên tạo liên kết π (hình 3.10b).
V - SỰ TẠO THÀNH LIÊN KẾT ĐƠN, LIÊN KẾT ĐÔI, LIÊN KẾT BA
1. Liên kết đơn
Ta đã biết, mỗi cặp electron chung của hai nguyên tử được tính là một liên kết và được biểu diễn bằng một gạch nối giữa kí hiệu của hai nguyên tử đó. Các nguyên tử trong các phân tử đã xét như H−H,H−Cl đều liên kết với nhau bằng liên kết đơn. Liên kết đơn luôn luôn là liên kết σ , được tạo thành từ sự xen phủ trục và thường bền vững.
2. Liên kết đôi
Trong phân tử etilen(C2H4), mỗi nguyên tử cacbon có sự lai hóa giữa một obitan s với hai obitan p theo kiểu lai hóa sp2. Các obitan lai hóa tạo một liên kết σ giữa hai nguyên tử cacbon và hai liên kết σ vơi hai nguyên tử hiđro. Mỗi nguyên tử cacbon còn một obitan p không tham gia lai hóa sẽ xen phủ bên với nhau tạo liên kết π. Liên kết giữa hai nguyên tử cacbon là liên kết đôi gồm một liên kết σ và một liên jết π. Các liên kết π kém bền hơn so với liên kết σ (hình 3.11).

3. Liên kết ba
Nguyên tử N có 5 electron lớp ngoài cùng, khi hình thành phân tử N2, mỗi nguyên tử góp 3 electron độc thân tạo thành ba liên kết. Người ta gọi đó là liên kết ba.
Chúng ta có thể dựa vào cấu hình electron lớp ngoài cùng của nguyên tử nitơ để giải thích liên kết trong phân tử nitơ.
Cấu hình electron lớp ngoài cùng của nguyên tử nitơ:
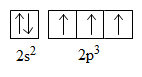
Mỗi nguyên tử nitơ dùng một obitan 2pz (quy ước lấy trục z làm trục liên kết) để tạo kiểu liên kết giữa hai nguyên tử theo kiểu xen phủ trục tạo liên kết σ.
Hai obitan p còn lại (2px,2py) sẽ xen phủ bên với nhau từng đôi một tạo ra hai liên kết π. Mỗi liên kết kí hiệu bằng một gạch nối, công thức cấu tạo của phân tử nitơ có dạng liên kết ba: gồm một liên kết σ và hai liên kết π.
N≡N
Công thức cấu tạo của phân tử nitơ
Liên kết giữa hai nguyên tử được thực hiện bởi một liên kết σ và một hay hai liên kết π được gọi là liên kết bội.