I. VỊ TRÍ, CẤU HÌNH ELECTRON NGUYÊN TỬ
S(Z = 16): 1s22s22p63s23p4
S ở ô 16, chu kì 3, nhóm VIA.
Lớp ngoài cùng có 6e
II. TÍNH CHẤT VẬT LÝ
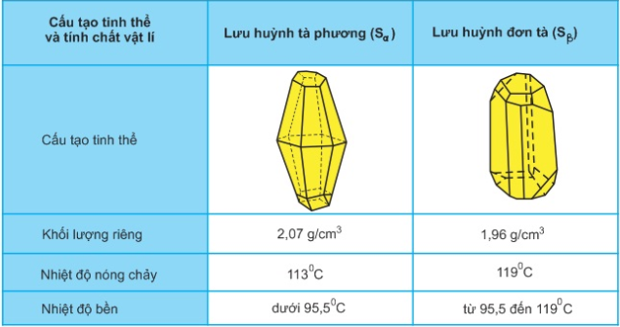
1. Hai dạng thù hình của lưu huỳnh

S có 2 dạng thù hình: lưu huỳnh tà phương (Sα) và lưu huỳnh đơn tà (Sβ)
Khác: cấu tạo tinh thể và một số tính chất vật lí
Giống: tính chất hóa học
Tùy thuộc vào nhiệt độ mà 2 dạng thù hình có thể biến đổi qua lại.
Sự biến đổi trạng thái:
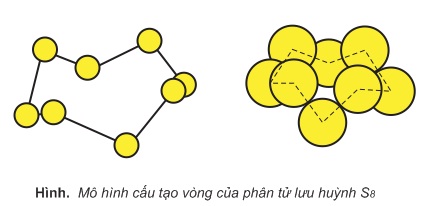
2. Ảnh hưởng của nhiệt độ đến tính chất vật lý
Ở nhiệt độ thấp hơn 113oC, Sα và Sβ là những chất rắn màu vàng. Phân tử lưu huỳnh có 8 nguyên tử liên kết cộng hóa trị với nhau tạo thành mạch vòng
III. TÍNH CHẤT HÓA HỌC
Cấu hình electron của S: 1s22s22p63s23p4
S khi tham gia phản ứng với kim loại hoặc Hidro, số oxi hóa của S sẽ giảm từ 0 xuống -2.
S khi tham gia phản ứng với phi kim hoạt động mạnh hơn như Oxi, Clo, Flo ... số oxi hóa của S tăng từ 0 lên
+4 hoặc + 6
1. Lưu huỳnh tác dụng với kim loại và hidro

Ở nhiệt độ cao, lưu huỳnh tác dụng với nhiều kim loại tạo ra muối sunfua và với hiđro tạo ra khí hiđrosunfua, S thể hiện tính oxi hóa.
2. Lưu huỳnh tác dụng với phi kim

⇒ Ở nhiệt độ thích hợp, lưu huỳnh tác dụng với một số phi kim mạnh hơn, S thể hiện tính khử.
IV. ỨNG DỤNG CỦA LƯU HUỲNH
Lưu huỳnh là nguyên liệu quan trọng cho nhiều ngành công nghiệp:
- 90% lượng lưu huỳnh sản xuất được dùng để điều chế H2SO4.
- 10% lượng lưu huỳnh còn lại được dùng để lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu và chất diệt nấm trong nông nghiệp,...
V. TRẠNG THÁI TỰ NHIÊN VÀ SẢN XUẤT LƯU HUỲNH
Dạng đơn chất: ở các mỏ lưu huỳnh, các mỏ chủ yếu tập trung gần các miệng núi lửa, suối nước nóng…
Dạng hợp chất: muối sunfat, muối sunfua…
Khai thác lưu huỳnh từ các mỏ lưu huỳnh: người ta dùng thiết bị đặc biệt để nén nước siêu nóng (170oC) vào mỏlàm lưu huỳnh nóng chảy và đẩy lên mặt đất. Sau đó lưu huỳnh được tách ra khỏi các tạp chất.