1. Giới thiệu chung
Thử nghiệm Tollens đề cập đến thuốc thử hóa học được sử dụng để phát hiện nhóm chức aldehyde, nhóm chức aldehyde thơm hoặc nhóm chức alpha hydroxy xeton trong một chất thử nghiệm nhất định. Đây có thể là:
1. Aldehyde (R-CHO) hoặc
2. Ketone (R-CO-R') trong đó R và R' là viết tắt của bất kỳ nhóm alkyl nào.
Thuốc thử Tollens được đặt theo tên của Bernhard Tollens, một nhà hóa học người Đức, người đã phát hiện ra thuốc thử này và công dụng của nó. Thuốc thử Tollens là dung dịch bạc nitrat (AgNO3 ) và Amoniac (NH3 ).
2. Mục đích của thử nghiệm Tollens là gì?
Bất cứ khi nào một hợp chất hữu cơ chưa biết được đưa ra để xác định, việc phân tích hợp chất một cách có hệ thống để phát hiện nhóm chức liên quan trở thành một bước rất quan trọng trong quá trình nhận dạng tổng thể. Các điểm sau giải thích việc sử dụng Thử nghiệm thuốc thử của Tollens trong phản ứng:
a. Phản ứng thích hợp dương tính với 2,4 - DNP (2,4-Dinitrophenylhydrazine) hoặc thuốc thửu Brady xác nhận sự có mặt của nhóm cacbonyl trong hợp chất. Nhưng nó không nói rõ nếu nhóm cacbonyl là một nhóm aldehyde hay là một nhóm ketone. Để phân biệt giữa hai chất này, người ta thực hiện thử nghiệm thuốc thử Tollens.
b. Aldehyde có thể dễ dàng bị oxy hóa thành axit cacboxylic tương ứng bằng cách sử dụng các chất oxy hóa nhẹ. Không giống như andehit, xeton không thể bị oxy hóa thành bất kỳ axit cacboxylic nào bằng các chất oxy hóa nhẹ. Để oxi hóa cần phải có chất oxy hóa mạnh. Thuốc thử Tollens có thể hoạt động như là một thuốc thử oxy hóa nhẹ.
c. Thuốc thử Tollens là một thuốc thửu oxy hóa nhẹ sẽ oxy hóa các nhóm aldehyde thành axit tương ứng và nó bị khử, sự giảm từ trạng thái oxy hóa +1 của Ag+ thành dạng nguyên tố bạc (Ag). Xeton không làm giảm thuốc thử Tollen (ngoại trừ alpha dixeton (tức là hai chức xeton trên nguyên tử lân cận) và xeton alpha hydroxy (nhóm chức xeton và rượu trên các nguyên tử lân cận) có thể biến đổi thành aldehyde thông qua đồng phân xeton -enol trong môi trường kiềm).
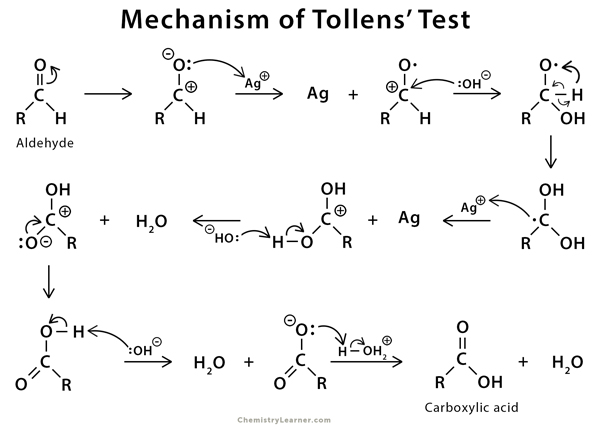
Phản ứng xảy ra trong Thử nghiệm Tollens như sau:
2. Cách điều chế thuốc thử Tollens
Vì Thuốc thử Tollens có thời hạn sử dụng tương đối ngắn, thuốc thử không được bán thương mại. Do đó, thuốc thử này thường được điều chế trực tiếp trong phòng thí nghiệm. Một phương pháp như vậy để điều chế Thuốc thử Tollens được mô tả dưới đây:
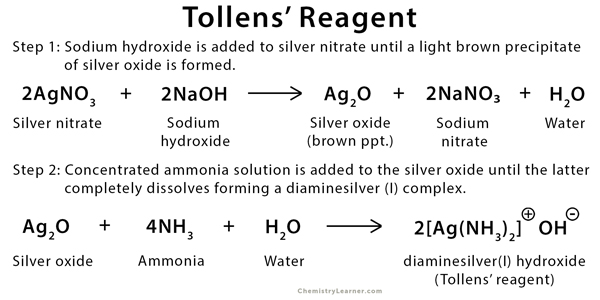
Bước 1: Nhỏ vài giọt NaOH loãng vào dung dịch nước chứa bạc nitrat. Dung dịch nước của bạc nitrat chứa các phức bạc nước, trong đó nước đóng vai trò là phối tử. Các ion hydroxit bây giờ chuyển đổi các phức bạc nước này thành các oxit bạc. Bạc oxit này (tạo bởi Ag2O) tạo ra chất rắn màu nâu từ dung dịch này. Phản ứng có thể được viết như sau.
2AgNO3 + 2NaOH → Ag2O (ppt màu nâu) + 2NaNO3 + H2O
Bước 2: Kết tủa màu nâu của bạc oxit được tạo ra ở bước 1 bây giờ được hòa tan bằng dung dịch nước amoniac. Dung dịch được tạo thành từ việc bổ sung amoniac trong nước này chứa phức [Ag(NH3)2]+ . Phức hợp này là thành phần chính của Thuốc thử Tollens. Phản ứng có thể được viết dưới dạng:
Ag2O (ppt màu nâu) + 4NH3 + 2NaNO3 + H2O → 2[Ag(NH3)2]NO3 + 2NaOH
Nhiều khi, thay vì tuân theo quy trình hai bước, quy trình một bước được tiến hành để thu được thuốc thử mới chuẩn bị. Đối với điều này, trước tiên, một lượng nhỏ amoniac trong nước (2ml) được thêm trực tiếp vào dung dịch bạc nitrat (2ml) được lấy trong ống nghiệm và sau đó để hòa tan kết tủa tạo thành, lượng vừa đủ dung dịch amoniac được rót theo thứ tự để có được một giải pháp rõ ràng.
Andehyde tạo kết tủa màu đen xám hoặc gương bạc khi nhỏ thuốc thử Tollens mới chuẩn bị vào dung dịch.
Một lượng nhỏ (50mg) hợp chất đã cho được hòa tan trong rượu không chứa aldehyde (2ml đóng vai trò là dung môi trung tính). Đối với dung dịch này, thuốc thứ Tollens mới chuẩn bị (1ml) được thêm vào và dung dịch được làm ấm trong nồi cách thủy nóng. Nếu tạo thành kết tủa đen xám hoặc soi gương bạc trên thành ống nghiệm thì chứng tỏ có aldehyde.
Trong phản ứng, ion bạc chuyển từ trạng thái oxi hóa +1 đến trạng thái oxi hóa 0 hoặc trại thái nguyên tố, do đó aldehyde bị khử và bị oxi hóa thành axit tương ứng. Do đó, phản ứng tham gia là phản ứng oxi hóa khử.
Vì phản ứng xảy ra trong môi trường kiềm nên axit cacboxylic không thu được trực tiếp thay vào đó là ion cacboxylat. Bạc bị kết tủa ở dạng nguyên tố tạo thành gương bạc ở các cạnh hoặc trên thành ống nghiệm. Nhiều lần, nếu thuốc thử Tollens được sử dụng không phải là dung dịch trong suốt thì kết tủa màu đen xám thu được cùng với gương bạc, đây cũng là kết quả dương tính với aldehyde.

3. Ví dụ
Carbohydrate về cơ bản là polyhydroxy Aldoses hoặc Ketose. Có một số carbohydrate có nhóm aldehyde tự do và những loại đường như vậy dễ dàng tham gia phản ứng thuốc thử Tollens, thuốc thử Fehling hoặc dung dịch Benedict và do đó được gọi là đường khử. Một số loại đường khử hoặc carbohydrate không có nhóm aldehyde nhưng chúng cũng cho kết quả xét nghiệm Tollens là dương tính vì đồng phân hóa trong môi trường kiềm và những loại đường này cũng được phân loại là đường khử. Do đó thuốc thử Tollens được sử dụng để xác định và phân biệt carbohydrate/đường trên cơ sở khả năng khử thuốc thử Tollens/ dung dịch Benedict hoặc dung dịch Fehling của chúng.
Ví dụ: Glucose là đường khử vì nó có nhóm chứ aldehyde tự do. Fructose không có bất kỳ nhóm aldehyde nào vẫn có thể đồng phân hóa thành glucose và mannose (bằng phương pháp đồng phân xeto-enol vì sự hiện diện của xeton alpha - hydroxyl trong môi trường kiềm, do đó cho kết quả dương tính với thuốc thử Tollens và do đó nó hoạt động như một chất khử đường. Tuy nhiên, saccarose một disaccarit không phản ứng với thuốc thử Tollens do đó hoạt động như một loại đường không khử vì thiếu nhóm carbonyl tự do.
Thuốc thử Tollens có độ pH cơ bản nhẹ vì sự hiện diện của NaOH tuy nhiên nó không có tính ăn mòn. Vì vậy, các biện pháp an toàn phòng thí nghiệm cơ bản là đủ trong khi xử lý các hóa chất đó.
Thuốc thử Tollens được sử dụng một cách chọn lọc trong phòng thí nghiệm hoặc trong công nghiệp hóa chất cho các mục đích khác nhau như trong quá trình phân tích hệ thống hợp chất hữu cơ...