1. Định nghĩa
Sự lai hóa orbital nguyên tử là sự tổ hợp các AO khác loại để tạo ra các AO hoàn toàn giống nhau về hình dạng, kích thước và năng lượng như có sự định hướng trong không gian khác nhau.
Khi có n AO tham gia lai hóa sẽ tạo ra n AO lai hóa. Các đám mây lai hóa bị dịch chuyển so với hạt nhân nguyên tử dẫn đến một đầu phình to ra (đầu +) và do vậy nó sẽ xen phủ hoàn toàn hơn với các đám mây tương tác, tạo được các liên kết hóa học bền vững.
2. Điều kiện để có sự lai hóa AO bền
Có 3 điều kiện lai hóa bền
- Năng lượng của các orbital nguyên tử tham gia lai hóa phải xấp xỉ nhau. Ví dụ AO 2s-2p; AO 3s-3p...
- Mật độ electron của AO tham gia lai hóa phải đủ lớn.
- Độ xen phủ của các AO lai hóa với các AO của các nguyên tử khác tham gia liên kết phải đủ lớn để tạo thành liên kết bền.
Từ các điều kiện trên ta thấy: Trong cùng một chu kì, khi đi từ trái sang phải hiệu năng lượng của AO-s với AO-p tăng lên nên khả năng tham gia lai hóa giảm xuống. Khi tăng kích thước nguyên tử, khả năng lai hóa của các AO hóa trị giảm xuống.
3. Một số dạng lai hóa AO thường gặp
Các dạng lai hóa thường gặp là sp, sp2, sp3 bên cạnh đó còn có một số kiểu lai hóa khác như sp3d, sp3d2

a. Lai hóa sp
Là sự tổ hợp 1AO-s kết hợp với 1AO-p tạo thành 2AO lai hóa sp, nằm thẳng hàng với nhau nhưng định hướng về hai phía đối nhau, góc lai hóa bằng 180o.
Ví dụ: nguyên tử Be trong phân tử BeCl2 hoặc nguyên tử C trong phân tử C2H2 ở trạng thái lai hóa sp
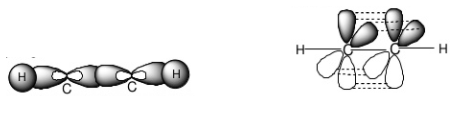
Phân tử C2H2
b. Lai hóa sp2
Là sự tổ hợp 1AO-s kết hợp với 2AO-p tạo thành 3 AO lai hóa sp2 nằm trong cùng một mặt phẳng, tạo với nhau những góc lai hóa bằng 120o hướng về ba đỉnh của một tam giác đều.
Ví dụ: nguyên tử B trong phân tử BF3 hoặc nguyên tử C trong phân tử C2H4 đều ở trạng thái lai hóa sp2.
c. Lai hóa sp3
Là sự tổ hợp 1AO-s kết hợp với 3AO-p tạo ra 4 AO lai hóa sp3 có hình dạng, kích thước và năng lượng hoàn toàn giống nhau, hướng về 4 đỉnh của một tứ diện đều, tạo thành các góc lai hóa 109o28'.
Ví dụ, sự lai hóa của các AO trong nguyên tử C của phân tử CH4.