1. Bán kính nguyên tử
Bán kính nguyên tử của một nguyên tố hóa học là kích thước nguyên tử của nguyên tố đó, thường là khoảng cách trung bình tính từ tâm của hạt nhân nguyên tử đến ranh giới ngoài cùng của đám mây electron. Vì ranh giới này không phải là một thực thể vật lý được xác định rõ ràng, nên có nhiều định nghĩa không tương đồng về bán kính nguyên tử. Ba định nghĩa được sử dụng phổ biến về bán kính nguyên tử là bán kính Van der Waals, bán kính ion, và bán kính cộng hóa trị tương ứng với 3 kiểu liên kết hóa học.
Tùy thuộc vào mỗi định nghĩa, thuật ngữ có thể chỉ áp dụng cho các nguyên tử bị cô lập, hoặc cũng cho các nguyên tử ở trang thái vật chất kết chặt, liên kết cộng hóa trị trong phân tử, hoặc trong các trạng thái kích thích và ion hóa; và giá trị của nó có thể được thu nhận thông qua các thí nghiệm, hoặc tính toán bằng các mô hình lý thuyết. Theo một vài định nghĩa, giá trị bán kính phụ thuộc vào trạng thái của nguyên tử.
Các electron không có quỹ đạo nhất định, hoặc dãi được xác định rõ ràng. Thêm nữa, các vị trí của chúng phải được mô tả là phân phối xác suất là tình trạng giảm dần khi ra xa hạt nhân, mà không có ranh giới rõ rệt. Ngoài ram ở trạng thái cô đặc/nén chặt và phân tử, các đám mây electron của nguyên tử thường chồng lấn ở một mức độ nhất định, và một vài electron có thể di chuyển trên một vùng rộng lớn giữa hai hoặc nhiều nguyên tử.
Định nghĩa phổ biến nhất, bán kính của các nguyên tử trung hòa cô lập nằm trong khoảng 30 đến 300 pm (hay 0,3 đến 3 angstrom). Tuy nhiên, bán kính của nguyên tử gấp 10.000 lần bán kính hạt nhân của nó (1–10 fm), và nhỏ hơn 1/1000 bước sóng của ánh sáng nhìn thấy (400–700 nm).
- Bán kính kim loại của một nguyên tố kim loại bằng nửa khoảng cách giữa tâm của các nguyên tử kim loại ở gần nhau nhất trong mạng lưới tinh thể kim loại.
- Bán kính cộng hóa trị của một nguyên tử bằng nửa khoảng cách giữa hạt nhân hai nguyên tử của cùng một nguyên tố tạo thành liên kết đơn cộng hóa trị.
Ví dụ, phân tử hidro gồm hai nguyên tử hidro liên kết với nhau bằng một liên kết đơn cộng hóa trị, khoảng cách giữa hai hạt nhân nguyên tử hidro bằng 74pm, vậy bán kính cộng hóa trị của nguyên tử hidro bằng 37 pm.
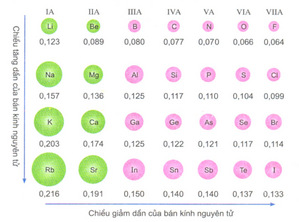
2. Sự biến đổi bán kính nguyên tử trong cùng một chu kì
a. Trong cùng một chu kì
Trong cùng một chu kì, khi đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử của các nguyên tố s,p có khuynh hướng giảm liên tục.
Nguyên nhân là vì trong cùng một chu kì số lớp electron của nguyên tử là như nhau, hiệu ứng chắn của các electron lớp bên trong là như nhau; từ trái qua phải, số điện tích hiệu dụng hạt nhân tăng, kết quả là hạt nhân hút electron lớp ngoài cùng ngày một mạnh hơn, bán kính nguyên tử giảm dần.
Bán kính của các nguyên tố d có khuynh hướng giảm chậm và không đều. Các nguyên tố f sự thay đổi còn chậm hơn nữa.
b. Trong cùng một nhóm
Sự biến đổi bán kính nguyên tử trong một nhóm
a. Đối với các nguyên tố thuộc nhóm A, từ trên xuống, bán kính nguyên tử có khuynh hướng tăng. Lí do: số lớp electron tăng, hiệu ứng chắn gây bởi electron bên trong tăng dần.
b. Đối với các nguyên tố thuộc nhóm B, khi chuyển từ nguyên tố đầu nhóm (chu kì 4) đến nguyên tố thứ hai (chu kì 5) bán kính có tăng lên, nguyên tố thứ hai đến nguyên tố thứ ba (chu kì 6) lẽ ra bán kính phải tăng thì thực tế bán kính ít thay đổi (có khi không đổi hoặc giảm chút ít), đó là do sự co rút lantan của 14 nguyên tố f đã đủ để bù trừ sự tăng bán kính phải xảy ra khi chuyển từ chu kì 5 qua chu kì 6. Kết quả có 10 nguyên tố d có bán kính cộng hóa trị xấp xỉ nhau, có cấu hình electron như nhau và có nhiều tính chất tương tự.