Giới thiệu về điều chế khí trong phòng thí nghiệm
Trong hóa học, việc điều chế khí trong phòng thí nghiệm là một phần không thể thiếu. Các khí này không chỉ quan trọng trong các thí nghiệm khoa học mà còn có ứng dụng rộng rãi trong đời sống và công nghiệp. Việc hiểu rõ các phương trình điều chế khí và ứng dụng thực tế trong bài này của SV388 sẽ giúp các bạn học sinh dễ dàng giải quyết các bài tập và áp dụng kiến thức vào thực tế.
Tổng hợp các phương trình điều chế khí phổ biến
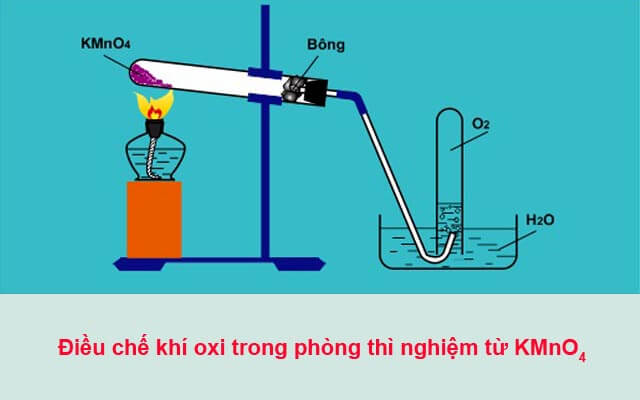
1. Điều chế khí O₂ (Oxy)
Oxy là khí cần thiết trong quá trình hô hấp của các sinh vật và trong nhiều phản ứng hóa học khác. Trong phòng thí nghiệm, oxy có thể được điều chế bằng cách phân hủy các hợp chất như kali clorat (KClO₃) hoặc peroxit.
Phương trình điều chế O₂:
2KClO3→to2KCl+3O22KClO₃ \xrightarrow{t^o} 2KCl + 3O₂2KClO3to2KCl+3O2
2. Điều chế khí H₂ (Hydro)
Hydro là một khí dễ cháy và có nhiều ứng dụng trong công nghiệp, đặc biệt là trong các pin nhiên liệu. Trong phòng thí nghiệm, hydro có thể được điều chế bằng cách phản ứng với kim loại như kẽm (Zn) trong dung dịch axit.
Phương trình điều chế H₂:
Zn+2HCl→ZnCl2+H2Zn + 2HCl \rightarrow ZnCl₂ + H₂Zn+2HCl→ZnCl2+H2
3. Điều chế khí CO₂ (Carbon dioxide)
Carbon dioxide là khí được sản sinh ra trong quá trình hô hấp của sinh vật và cũng có ứng dụng trong công nghiệp, đặc biệt là trong các bình chữa cháy và chế tạo đồ uống có ga.
Phương trình điều chế CO₂:
CaCO3→toCaO+CO2CaCO₃ \xrightarrow{t^o} CaO + CO₂CaCO3toCaO+CO2
4. Điều chế khí NH₃ (Ammoniac)
Ammoniac là khí có tính bazơ mạnh và là thành phần chính trong phân bón. Trong phòng thí nghiệm, NH₃ có thể được điều chế bằng cách cho ammonium chloride (NH₄Cl) phản ứng với dung dịch kiềm.
Phương trình điều chế NH₃:
NH4Cl+NaOH→NaCl+NH3+H2ONH₄Cl + NaOH \rightarrow NaCl + NH₃ + H₂ONH4Cl+NaOH→NaCl+NH3+H2O
5. Điều chế khí SO₂ (Sulfur dioxide)
Sulfur dioxide được điều chế trong phòng thí nghiệm bằng cách đun nóng sulfur với oxy hoặc qua phản ứng giữa kim loại và axit.
Phương trình điều chế SO₂:
S+O2→SO2S + O₂ \rightarrow SO₂S+O2→SO2
6. Điều chế khí Cl₂ (Clo)
Clo là một khí có tính oxi hóa mạnh, được ứng dụng trong việc khử trùng nước và trong công nghiệp sản xuất hóa chất. Clo có thể được điều chế từ natri clorua bằng phương pháp điện phân.
Phương trình điều chế Cl₂:
2NaCl→điệnpha^nCl2+2Na2NaCl \xrightarrow{điện phân} Cl₂ + 2Na2NaClđiệnpha^nCl2+2Na
Phân biệt giữa điều chế khí trong phòng thí nghiệm và công nghiệp
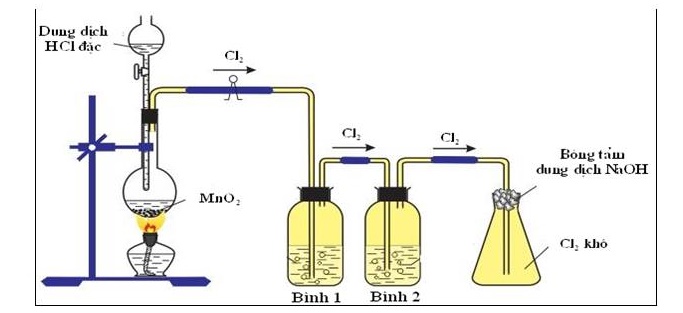
Điều chế trong phòng thí nghiệm
Trong phòng thí nghiệm, điều chế khí thường diễn ra ở quy mô nhỏ, với mục đích nghiên cứu hoặc thí nghiệm. Các phương pháp điều chế khí ở quy mô này thường yêu cầu các phản ứng hóa học đơn giản và dễ thực hiện. Thí dụ như:
- Điều chế khí O₂ từ kali clorat bằng nhiệt.
- Điều chế khí CO₂ từ phản ứng giữa axit và muối cacbonat.
- Điều chế khí H₂ bằng phản ứng giữa kim loại và axit.
Điều chế khí trong phòng thí nghiệm cần các dụng cụ như bình sinh khí, ống nghiệm, ống dẫn khí và bình đựng nước vôi trong để thu khí.
Điều chế khí trong công nghiệp
Trong công nghiệp, việc điều chế khí thường liên quan đến quy mô lớn và cần áp dụng các công nghệ tiên tiến. Ví dụ:
- Điều chế oxy (O₂) trong công nghiệp có thể sử dụng quá trình phân tách không khí qua phương pháp chưng cất phân đoạn.
- Điều chế khí H₂ trong công nghiệp thường được thực hiện qua quá trình reforming khí tự nhiên hoặc quá trình điện phân nước.
- Điều chế khí NH₃ được thực hiện thông qua quá trình Haber-Bosch, sử dụng phản ứng giữa khí nitơ và hydro dưới điều kiện nhiệt độ và áp suất cao.
Công nghiệp sử dụng các thiết bị quy mô lớn và quy trình tự động để tối ưu hóa năng suất và hiệu quả.
Ứng dụng của các khí điều chế trong đời sống và công nghiệp
Các khí điều chế trong phòng thí nghiệm không chỉ có giá trị nghiên cứu mà còn có ứng dụng rất lớn trong đời sống và công nghiệp.
1. Ứng dụng khí O₂ (Oxy)
Oxy có vai trò quan trọng trong đời sống sinh học và công nghiệp. Oxy được sử dụng trong các bệnh viện, trong hàn cắt kim loại, và trong sản xuất thép. Ngoài ra, oxy còn có ứng dụng trong việc tạo ra các phản ứng cháy trong động cơ và lò luyện kim.
2. Ứng dụng khí H₂ (Hydro)
Hydro được sử dụng trong công nghiệp sản xuất amoniac (NH₃) cho phân bón, trong công nghệ lọc dầu, và trong sản xuất năng lượng từ pin nhiên liệu. Hydro cũng là một thành phần quan trọng trong công nghiệp thực phẩm, đặc biệt trong việc hydrogen hóa dầu ăn.
3. Ứng dụng khí CO₂ (Carbon dioxide)
CO₂ có ứng dụng trong công nghiệp thực phẩm, như trong các đồ uống có gas. Ngoài ra, CO₂ còn được sử dụng trong công nghiệp chế tạo khí làm lạnh và trong các hệ thống chữa cháy. Nó cũng có mặt trong các nghiên cứu sinh học và hóa học, như trong quá trình quang hợp của cây xanh.
4. Ứng dụng khí NH₃ (Ammoniac)
Ammoniac chủ yếu được sử dụng trong sản xuất phân bón và thuốc trừ sâu. Nó cũng là nguyên liệu trong công nghiệp sản xuất nhựa, sợi tổng hợp, và các hóa chất công nghiệp khác.
5. Ứng dụng khí SO₂ (Sulfur dioxide)
SO₂ được sử dụng trong công nghiệp chế biến thực phẩm như chất bảo quản và trong sản xuất axit sulfuric, một hóa chất quan trọng trong công nghiệp hóa chất và luyện kim.
6. Ứng dụng khí Cl₂ (Clo)
Clo có ứng dụng trong việc khử trùng nước, sản xuất thuốc tẩy, và trong công nghiệp chế tạo nhựa PVC. Clo cũng được sử dụng trong quá trình sản xuất nhiều hóa chất khác như axit clohidric (HCl).
Sơ đồ phản ứng và mẹo học thuộc nhanh
Để nhớ các phương trình điều chế khí, bạn có thể sử dụng sơ đồ phản ứng và các mẹo học thuộc sau:
- Học theo nhóm khí: Nhóm khí như O₂, CO₂, H₂ có thể được nhớ trong một nhóm các phương trình có liên quan đến sự phân hủy và phản ứng với axit.
- Học qua hình ảnh và sơ đồ: Việc vẽ sơ đồ hoặc hình minh họa các phản ứng sẽ giúp bạn dễ dàng ghi nhớ hơn.
- Thực hành làm bài tập: Làm càng nhiều bài tập càng giúp bạn ghi nhớ lâu và nắm vững các phương trình điều chế khí.
Kết luận
Phương trình điều chế khí trong phòng thí nghiệm là nền tảng quan trọng trong việc học hóa học. Hiểu rõ các phương trình và ứng dụng của các khí này không chỉ giúp học sinh giải quyết các bài tập hiệu quả mà còn ứng dụng vào công việc thực tế trong công nghiệp. Hãy luôn chủ động và áp dụng phương pháp học đúng đắn để làm chủ kiến thức hóa học, và đừng quên tìm hiểu thêm các nguồn tài liệu như SV388 để nâng cao khả năng học tập của bạn.