Giới thiệu về phản ứng oxi hóa – khử
Trong chương trình Hóa học phổ thông, phản ứng oxi hóa – khử là một phần không thể thiếu. Nó không chỉ xuất hiện trong các bài học lý thuyết mà còn trong các bài tập thực hành, phản ứng trong phòng thí nghiệm. Việc hiểu rõ về oxh – khử sẽ giúp các bạn học sinh có thể giải quyết các bài tập hóa học một cách dễ dàng và chính xác. Vin777 sẽ giúp bạn một số khái niệm và bài tập.
Khái niệm về oxi hóa và khử
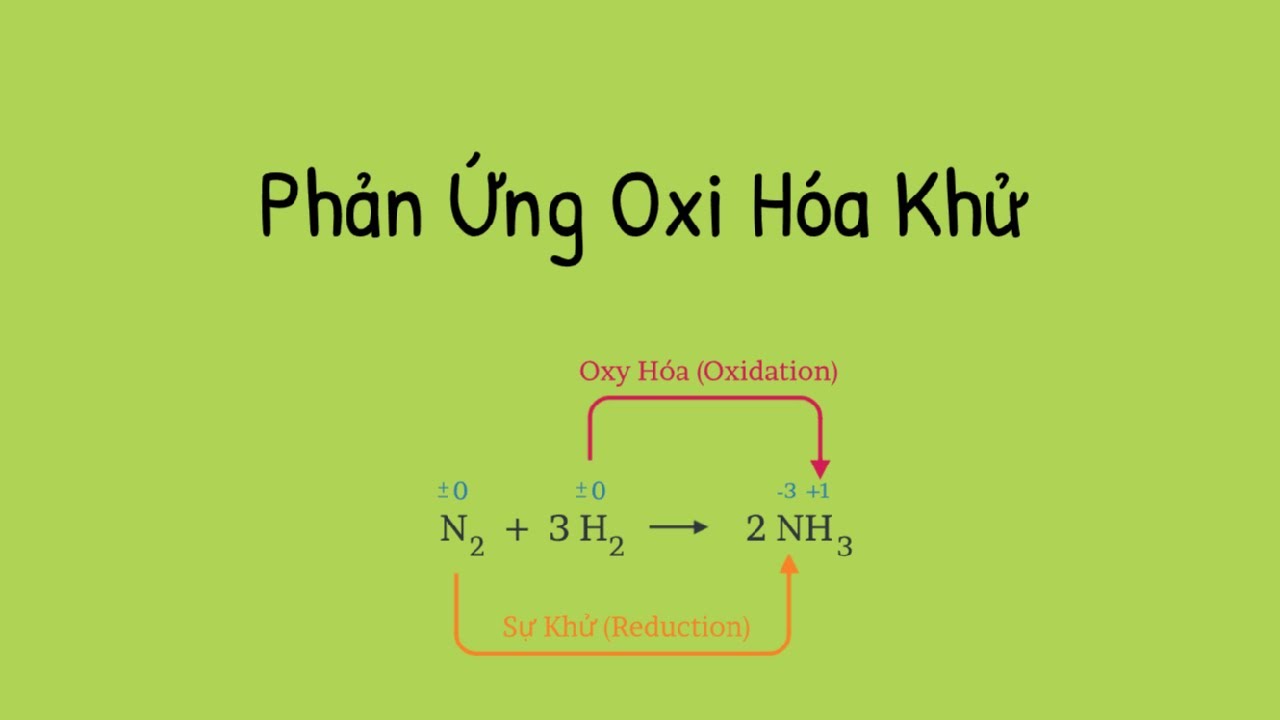
Phản ứng oxi hóa – khử là loại phản ứng hóa học trong đó có sự chuyển giao electron giữa các chất tham gia. Khi đó, một chất sẽ bị oxi hóa (mất electron), trong khi một chất khác sẽ bị khử (nhận electron).
- Oxi hóa là quá trình mà một chất mất đi electron.
- Khử là quá trình mà một chất nhận electron.
Ví dụ, trong phản ứng giữa kali permanganat (KMnO₄) và axit clohidric (HCl), mangan (Mn) trong KMnO₄ bị oxi hóa, trong khi clor (Cl) trong HCl bị khử.
Dấu hiệu nhận biết phản ứng oxi hóa – khử trong phương trình hóa học
Phương pháp nhận biết đơn giản
Một trong những dấu hiệu dễ nhận biết phản ứng oxi hóa – khử trong phương trình hóa học là sự thay đổi của hệ số oxy hóa của các nguyên tố trong phản ứng. Các bạn có thể nhận thấy điều này qua các bước sau:
1. Thay đổi hóa trị: Chất bị oxi hóa sẽ có hóa trị tăng, còn chất bị khử sẽ có hóa trị giảm.
Ví dụ: trong phản ứng Fe → Fe²⁺ + 2e⁻, sắt (Fe) bị oxi hóa từ hóa trị 0 thành Fe²⁺.
2. Sự xuất hiện của các chất oxi hóa mạnh: Những chất oxi hóa mạnh như O₂, KMnO₄, Cr₂O₇²⁻ thường xuyên xuất hiện trong các phản ứng oxi hóa – khử.
Ứng dụng của phản ứng oxi hóa – khử
Phản ứng oxi hóa – khử có nhiều ứng dụng trong đời sống hàng ngày. Một số ví dụ điển hình có thể kể đến như:
- Đề phòng rỉ sét: Khi sắt bị oxi hóa, tạo thành rỉ sét.
- Hệ thống điện trong cơ thể: Sự trao đổi electron trong cơ thể giúp duy trì các phản ứng sinh hóa.
- Quá trình điều chế kim loại: Nhiều kim loại được điều chế từ quặng bằng phương pháp khử.
Mẹo cân bằng phương trình oxi hóa – khử (thăng bằng electron)
Một trong những vấn đề khó khăn đối với nhiều học sinh là cân bằng phương trình oxi hóa – khử. Đây là bước quan trọng để đảm bảo rằng các phản ứng diễn ra theo đúng lý thuyết.
Các bước cân bằng phương trình oxi hóa – khử
Bước 1: Viết phương trình chưa cân bằng
Đầu tiên, viết phương trình hóa học của phản ứng oxi hóa – khử. Ví dụ:
Fe+Cl2→FeCl3Fe + Cl_2 \rightarrow FeCl_3Fe+Cl2→FeCl3.
Bước 2: Phân tích sự thay đổi hóa trị
Đối với các nguyên tố trong phản ứng, xác định sự thay đổi hóa trị của chúng để biết chất nào bị oxi hóa, chất nào bị khử.
Bước 3: Cân bằng electron
Cân bằng số lượng electron trao đổi giữa các chất oxi hóa và khử. Một số bài tập sẽ yêu cầu bạn phải thăng bằng electron trước khi cân bằng toàn bộ phương trình.
Bước 4: Cân bằng các nguyên tố khác ngoài O và H
Sau khi cân bằng electron, cân bằng các nguyên tố còn lại như O và H.
Bước 5: Kiểm tra lại
Kiểm tra lại phương trình xem đã đảm bảo đúng về số nguyên tử của mỗi loại nguyên tố chưa.
Ví dụ minh họa
Giả sử phản ứng:
Fe+Cl2→FeCl3Fe + Cl_2 \rightarrow FeCl_3Fe+Cl2→FeCl3
Bước 1: Viết phương trình
Fe+Cl2→FeCl3Fe + Cl_2 \rightarrow FeCl_3Fe+Cl2→FeCl3.
Bước 2: Phân tích sự thay đổi hóa trị
Fe (hóa trị 0) trở thành Fe³⁺ (hóa trị +3), trong khi Cl₂ (hóa trị 0) trở thành Cl⁻ (hóa trị -1).
Bước 3: Cân bằng electron
Fe mất 3 electron, Cl₂ nhận 2 electron (phải nhân hệ số của Fe và Cl₂ sao cho số electron được trao đổi cân bằng).
Bước 4: Cân bằng các nguyên tố
Cân bằng số nguyên tử của Fe và Cl ở cả hai vế của phương trình.
Phương trình cuối cùng là:
2Fe+3Cl2→2FeCl32Fe + 3Cl_2 \rightarrow 2FeCl_32Fe+3Cl2→2FeCl3.
Ví dụ bài tập và lời giải
Bài tập 1: Cân bằng phương trình sau
Câu hỏi:
Cân bằng phương trình sau:
MnO4−+H+→Mn2++H2OMnO_4^- + H^+ \rightarrow Mn^{2+} + H_2OMnO4−+H+→Mn2++H2O.
Lời giải:
Bước 1: Viết phương trình chưa cân bằng
MnO4−+H+→Mn2++H2OMnO_4^- + H^+ \rightarrow Mn^{2+} + H_2OMnO4−+H+→Mn2++H2O.
Bước 2: Xác định sự thay đổi hóa trị
Mn trong MnO4−MnO_4^-MnO4− có hóa trị +7, sau khi khử, Mn trở thành Mn2+Mn^{2+}Mn2+ với hóa trị +2.
Bước 3: Cân bằng electron
Mn chuyển từ +7 xuống +2, mất 5 electron.
Bước 4: Cân bằng phương trình
Cân bằng số nguyên tử, đảm bảo số electron trao đổi là như nhau ở cả hai vế.
Phương trình cuối cùng là:
MnO4−+8H++5e−→Mn2++4H2OMnO_4^- + 8H^+ + 5e^- \rightarrow Mn^{2+} + 4H_2OMnO4−+8H++5e−→Mn2++4H2O.
Kết luận
Phản ứng oxi hóa – khử là một phần không thể thiếu trong hóa học phổ thông. Việc hiểu đúng về oxi hóa và khử, cùng với các bước cân bằng phương trình, sẽ giúp học sinh dễ dàng giải quyết các bài tập khó. Để thực hành và học hỏi thêm, bạn có thể tham khảo các bài tập và phương pháp giải bài tại các nền tảng học trực tuyến như Vin777, nơi có đầy đủ tài liệu và hướng dẫn chi tiết cho mọi cấp độ.